Прогнозирование энтропии образования органических веществСтатьи / Прогнозирование энтропии образования органических веществСтраница 3
Для соединений, имеющих гетероатомы, необходимо также рассматривать пространственное строение структурных фрагментов, в которые входят эти атомы. Например, аминогруппа вместе с ближайшим углеродным атомом обладает структурой пирамиды, поэтому для группы CNH2 число симметрии внутреннего вращения равно единице.
Итак, с вопросом определения чисел симметрии молекул мы в общих чертах познакомились. Наличие в молекуле осей симметрии внутреннего вращения понижает энтропию вещества. Чтобы ввести поправку на симметрию, необходимо из вращательной энтропии вычесть ![]() , т.е.
, т.е.
![]() . (2.8)
. (2.8)
Иной тип поправок приходится вводить в случае, когда интересующее нас вещество имеет хиральные центры и вследствие этого представлено смесью устойчивых форм вращательных изомеров (возможны и другие ситуации). Поскольку энтропия отражает степень упорядоченности системы, то для смеси изомеров необходимо учитывать энтропию смешения
![]() , (2.9)
, (2.9)
где ni - мольная доля i-того изомера в равновесной смеси. Если все изомеры имеют равную энергию, то ni = 1/n и
![]() . (2.10)
. (2.10)
Следовательно, для бинарной смеси с концентрацией каждого изомера 50% или 0,5 мол. долей имеем ![]() = 5,76 Дж/(моль×К).
= 5,76 Дж/(моль×К).
Количество пространственных изомеров органического соединения может быть весьма значительным и зависит от количества элементов хиральности в молекуле, которыми могут быть [31]:
· асимметрические углеродные атомы, т.е. атомы, у которых все четыре заместителя разные, например, центральный атом углерода в молочной кислоте
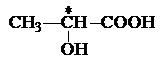 ;
;
· атомы кремния с четырьмя различными заместителями, например, в молекуле метил-(1-нафтил)фенилсилана;
· атомы трехвалентного фосфора в фосфинах или четырехвалентной серы в сульфоксидах с набором различных заместителей при фосфоре или сере, в соединениях которых заместители расположены пирамидально, но структуры являются фактически тетраэдрическими с учетом свободной электронной пары;
· центр молекулы адамантанового ядра с различными заместителями в 1,3,5,7-положениях адамантана;
· оси хиральности, например, для молекул алленов с различными заместителями при крайних углеродных атомах или для 2,2',6,6'-тетра-замещенных бифенилов, размеры заместителей в молекулах которых препятствуют вращению вокруг простой углерод-углеродной связи между ароматическими ядрами, если сумма ван-дер-ваальсовых радиусов орто-заместителей превосходит 0,290 нм; таким соединениям свойственна пространственная изомерия (атропоизомерия - где тропос - поворот (греч.), атропо- нет поворота);
· плоскости хиральности, например, в производных ферроцена;
· спиральность, например, в белках, нуклеиновых кислотах или гелиценах (простейшая модель спиральности) с шестью и более орто-конденсированными бензольными ядрами, которые не могут расположиться в одной плоскости и образуют правую или левую спираль.
Из перечисленных элементов хиральности для относительно несложных структур наиболее часто встречающимися являются асимметрические углеродные атомы. В этом случае максимальное количество оптических изомеров равно ![]() , где “m” - число асимметрических атомов углерода.
, где “m” - число асимметрических атомов углерода.
Если набор заместителей при различных асимметрических углеродных атомах одинаков, то количество оптических изомеров уменьшается вследствие образования мезо-формы. При расчете величины поправки на смешение оптических изомеров в этом случае концентрация мезо-формы в первом приближении может быть принята равной суммарной концентрации равновесной с ней dl-формы. Таким образом, для структур с двумя асимметрическими атомами в молекуле имеем поправку на смешение оптических изомеров, равную
![]() = –8,3147·(0,5·ln(0,5)+0,25·ln(0,25)+0,25·ln(0,25)) =
= –8,3147·(0,5·ln(0,5)+0,25·ln(0,25)+0,25·ln(0,25)) =
= 8,64 Дж/(моль×К).
Если центры асимметрии находятся не при соседних атомах, то весь соединяющий их фрагмент считают за одну связь.
Наличие асимметрических углеродных атомов в циклических соединениях также требует при прогнозировании энтропии учета вклада на смешение оптических изомеров. Однако при этом необходимо учитывать специфику строения молекул интересующего циклического соединения.
Смотрите также
Ртуть (Hydrargyrum), Hg
Каждому, кто хоть раз держал в руках термометр - "градусник", знакома ртуть. По своим химическим свойствам - это настоящий металл, но в отличие от других металлов жидкий при комнатной темпер ...
Эксклюзионная хроматография
...
Теллур (Tellurium), Te
Теллур - химический элемент VI группы главной подгруппы периодической системы Менделеева; атомный номер 52, атомная масса 127,60, относится к редким рассеянным элементам. В природе встречается в виде ...
