ЖелезоМатериалы / ЖелезоСтраница 1
ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
Побочная подгруппа восьмой группы периодической системы охватывает три триады d-элементов. Первую триаду образуют элементы железо, кобальт и никель, вторую триаду — рутений, родий и палладий и третью триаду — осмий, иридий и платина.
На сестру mobixit.ru/ringtony-na-sestru/ рингтоны скачать . Продажа сейфов kazan.profsafe.ru/safes/.Большинство элементов рассматриваемой подгруппы имеют два электрона в наружном электронном слое атома; все они представляют собой металлы. Кроме наружных электронов, в образовании химических связей принимают участие также электроны из предыдущего недостроенного слоя. Для этих элементов характерны степени окисленности, равные 2, 3, 4. Более высокие степени окисленности проявляются реже. В периодической системе железо находится в четвертом периоде, в побочной подгруппе VIII группы.
Химический знак — Fе (феррум). Порядковый номер — 26, электронная формула 1s22s22p63s23p63d64s2. Электронно-графическая формула:
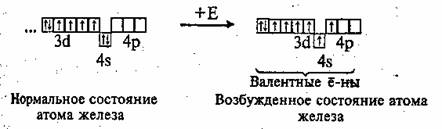
Валентные электроны у атома железа находятся на последнем электронном слое (4s2) и предпоследнем (Зd6). В химических реакциях железо может отдавать эти электроны и проявлять степени окисления +2, +3 и иногда +6.
Сравнение физических и химических свойств элементов восьмой группы показывает, что железо, кобальт и никель, находящиеся в первом большом периоде, очень сходны между собой и в то же время сильно отличаются от элементов двух других триад. Поэтому их обычно выделяют в семейство железа. Остальные шесть элементов восьмой группы объединяются под общим названием платиновых металлов.
СЕМЕЙСТВО ЖЕЛЕЗА
. Железо (Ferrum). Нахождение в природе. Железо—самый распространенный после алюминия металл на земном шаре: оно
Таблица: Некоторые свойства железа, кобальта и никеля
|
Ре |
Со |
N1 | |
|
Радиус атома, нм |
0,126 |
0,125 |
0,124 |
|
Энергия ионизации | |||
|
Э → Э+, эВ |
7,89 |
7,87 |
7,63 |
|
Э+ → Э2+, эВ |
16,2 |
17,1 |
18,15 |
|
Э2+, → ЭЗ+, эВ |
30,6 |
33,5 |
35,16 |
|
Радиус иона Э2+, нм |
0,080 |
0,078 |
0,074 |
|
Радиус иона Э3+, нм |
0,067 |
0,064 | |
|
Стандартная энтальпия ато- |
417,0 |
428,4 |
428,8 |
|
мизации металла при 25° С, | |||
|
кДж на 1 моль атомов | |||
|
Плотность, г/см3 |
7,87 |
8,84 |
8,91 |
|
Температура плавления, °С |
1539 |
1492 |
1455 |
|
Температура кипения, °С |
2870 |
3100 |
2900 |
|
Стандартный электродный по |
-0,440 |
-0,277 |
—0,250 |
|
тенциал процесса Э2 + | |||
|
+2е=Э, В |
Смотрите также
Калий (Kalium), К
Рассказ об этом элементе можно начать словами известного немецкого химика Юстуса Либиха: "Отдайте почве то, что вы у нее взяли, или не ждите от нее в будущем столько, сколько она давала раньше&qu ...
Астат (Astatium), At
Астат - радиоактивный химический элемент VII группы периодической системы Менделеева, атомный номер 85. Стабильных изотопов у А. нет; известно не менее 20 радиоактивных изотопов А., из которых наиболе ...
Молибден (Molybdaenum), Mo
Открыт в 1778 году шведским химиком Карлом Шееле, который прокаливая молибденовую кислоту, получил оксид МоО3. В металлическом состоянии впервые получен П. Гьельмом в 1782 г. восстановлением оксида уг ...
