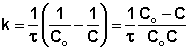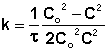Химическая кинетикаМатериалы / Химическая кинетикаСтраница 4
![]()
где М - третья частица. Суммарный порядок таких реакций - третий (скорость u = = k[М][Сl]2, где k-константа скорости), но молекулярность равна 2, т.к. в хим. взаимодействии участвуют два атома хлора, а частица М лишь принимает на себя энергию, выделившуюся при рекомбинации атомов, не претерпевая при этом хим. превращения.
Методы определения порядка реакции
Проведение реакции в условиях, когда концентрация одного из реагентов много меньше концентрации другого (других) и скорость реакции зависит от концентрации только этого реагента, используется для определения частных порядков реакции – это т.н. метод избыточных концентраций или метод изолирования Оствальда. Порядок реакции по данному веществу определяется одним из перечисленных ниже методов.
Графический метод заключается в построении графика зависимости концентрации реагента от времени в различных координатах. Для различных частных порядков эти зависимости имеют следующий вид:
|
Порядок реакции |
Зависимость концентрации от времени |
|
1 |
|
|
2 |
|
|
3 |
|
Если построить графики этих зависимостей на основании опытных данных, то лишь одна из них будет являться прямой линией. Если, например, график, построенный по опытным данным, оказался прямолинейным к координатах lnC = f(t), то частный порядок реакции по данному веществу равен единице.
Метод подбора кинетического уравнения заключается в подстановке экспериментальных данных изучения зависимости концентрации вещества от времени в кинетические уравнения различных порядков. Подставляя в приведённые в таблице уравнения значения концентрации реагента в разные моменты времени, вычисляют значения константы скорости. Частный порядок реакции по данному веществу равен порядку того кинетического уравнения, для которого величина константы скорости остаётся постоянной во времени.
|
Порядок реакции |
Выражение для константы скорости |
|
1 |
|
|
2 |
|
|
3 |
|
Метод определения времени полупревращения заключается в определении t1/2 для нескольких начальных концентраций. Как видно из приведённых в таблице уравнений, для реакции первого порядка время полупревращения не зависит от Co, для реакции второго порядка – обратно пропорционально Co, и для реакции третьего порядка – обратно пропорционально квадрату начальной концентрации.
|
Порядок реакции |
Выражение для периода полупревращения |
|
1 |
|
|
2 |
|
|
3 |
|
По характеру зависимости t1/2 от Co нетрудно сделать вывод о порядке реакции по данному веществу. Данный метод, в отличие от описанных выше, применим и для определения дробных порядков.
Таким образом, характер изменения концентрации реагента во времени, период полураспада и единица измерения константы скорости реакции зависят от порядка реакции.
Влияние температуры на скорость реакции
Правило Вант-Гоффа.
Повышение температуры ускоряет большинство химических реакций. Согласно правилу Вант-Гоффа при повышении температуры на 10 К скорость многих реакций увеличивается в 2-4 раза
Смотрите также
Классификация, количественные определения минеральных удобрений
Минеральные удобрения
— это соединения, способные при внесении в почву растворяться и диссоциировать
на ионы в почвенном растворе, чрезвычайно необходимые для жизни растений,
поскольку соде ...
Рентгенофлуоресцентное определение редких элементов Sr, Rb, Nb в литий-фтористых редкометальных гранитах
Научный и практический интерес к литий-фтористым редкометальным
гранитам обусловлен уникальностью их химического и минерального состава, а
также экстремальными (вплоть до рудных) концентраци ...
Менделеев Дмитрий Ивановы и химия
Менделеев Дмитрий Ивановы-великий русский химик, открыватель периодического закона химических элементов. Родился 27 января 1834. в Сибири, в Тобольске.
Отец Менделеева был директором гимназии, но, ...