Химическая кинетикаМатериалы / Химическая кинетикаСтраница 3
![]() (7.10)
(7.10)
Так как ![]() безразмерен, то константа скорости реакции первого порядка имеет единицу измерения обратного времени
безразмерен, то константа скорости реакции первого порядка имеет единицу измерения обратного времени ![]() .
.
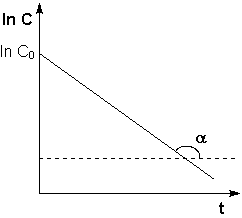
Из графика изменения концентрации реагента во времени (рис 7.1а) легко определяется константа скорости реакции:
![]()
а б
(рис 7.1) изменение концентрации исходных веществ во времени для реакций первого (а) и второго (б) порядков.
В качестве критерия скорости реакции нередко используется период полураспада ![]() , равный времени, в течение которого концентрация реагента уменьшается в два раза. Т.е.
, равный времени, в течение которого концентрация реагента уменьшается в два раза. Т.е. ![]() , подставляя
, подставляя ![]() и
и ![]() в (7.10), и преобразуя получаем
в (7.10), и преобразуя получаем
![]() (7.11)
(7.11)
Период полураспада реагента в случае реакции первого порядка не зависит от начальной концентрации, а определяется лишь константой скорости. Реакции по уравнению (7.11) можно рассчитать константу скорости реакции, если известен период полураспада.
Скорость реакции второго порядка для двух B и D подчиняется кинетическому уравнению:
![]() (7.12)
(7.12)
Если ![]() или если реагируют одинаковые частицы, то
или если реагируют одинаковые частицы, то
![]() (7.13)
(7.13)
Второй порядок имеют, например реакции разложения йодида водорода и диоксида азота:
![]()
Как показывает анализ, характер изменения концентрации реагента во времени одинаков как для (7.12), так и для (7.13). Используя уравнение (7.2) и разделяя переменные:
![]()
Решение уравнения для начального условия ![]() имеет вид:
имеет вид:
![]() (7.14)
(7.14)
или
![]() (7.15)
(7.15)
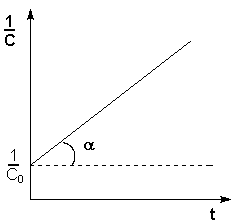
Уравнение (7.15) является уравнением кинетической кривой реакции второго порядка. Как видно концентрация реагента изменяется во времени по сложному закону. Величина обратная концентрации растёт во времени линейно. Из уравнения (7.14) получим выражение для константы скорости реакции
![]() (7.16)
(7.16)
Из анализа единиц измерения уравнения (7.16) с ![]() и
и ![]() , получим единицу измерения константы скорости реакции k
, получим единицу измерения константы скорости реакции k ![]() . Константу скорости реакции можно определить графически по экспериментальной кривой (рис 7.1б)
. Константу скорости реакции можно определить графически по экспериментальной кривой (рис 7.1б)
![]()
Период полупревращения в данном случае уменьшается с ростом концентрации реагента.
![]() (7.17)
(7.17)
Измерения константы скорости для реакций третьего порядка производиться по формуле:
![]()
Молекулярность химической реакции
Молекулярность химической реакции - число частиц реагентов, взаимодействующих друг с другом в одной элементарной (простой) реакции и превращающихся в продукты. Так, для реакций в растворах молекулярность реакции не учитывает число молекул растворителя, образующих сольватную оболочку или молекулярные комплексы с реагентами, т. к. эти молекулы не входят в состав продуктов реакции. В р-циях замещения и элиминирования орг. соед., протекающих часто в неск. стадий, М. р. оценивается как число молекул, претерпевающих хим. превращение в лимитирующей стадии. Соответственно числу реагирующих частиц различают мономолекулярные реакции, бимолекулярные реакции и тримолекулярные реакции, отличающиеся кинетическими закономерностями и механизмом. Как правило, молекулярность простой реакции совпадает с порядком реакции, однако бывают и несовпадения. Напр., рекомбинации атомов в газовой фазе протекают через тройные столкновения типа:
Смотрите также
Осветительные приборы аварийного освещения
Охранное освещение должно предусматриваться вдоль границ территорий, охраняемых в ночное время. Освещенность должна быть не менее 0,5 лк на уровне земли в горизонтальной плоскости или на уровне 0,5 м ...
Результаты и обсуждения
Цель работы:
1)
Исследование
комплексообразования кальция с поливинилпирролидоном различными
ф ...
Практическая часть.
Если к раствору сульфата меди (II) прилить избы концентрированного водного раствора
аммиака, то жидкость окрасит< интенсивный синий цвет, обусловленным образованием
комплексного ион [Cu(NH3)4]2+ ...
