Химическая кинетикаМатериалы / Химическая кинетикаСтраница 6
Возможность образования активированного комплекса, а соответственно и химического взаимодействия определяется энергией молекул. Как видно из рис 7.4, с увеличением температуры растет и доля молекул способных к активным столкновениям с образованием активированного комплекса, т.е. происходит ускорение реакции.
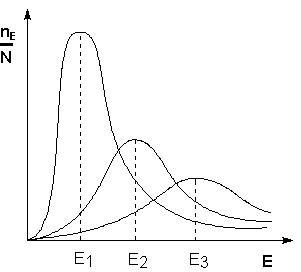
(рис 7.4) Кинетическая энергия молекул
Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические (см. рис. 7.3.). Высокая энергия активации является причиной того, что многие химические реакции при не высоких температурах не протекают, хотя возможны (![]() ). Так в обычных условиях не горит бумага, уголь и т.д., хотя энергия Гиббса реакций окисления <0 (
). Так в обычных условиях не горит бумага, уголь и т.д., хотя энергия Гиббса реакций окисления <0 (![]() ).
).
Раздел химии, изучающий реакции в низкотемпературной плазме, получил название плазмохимии, а изучающий химические реакции в сверхнизких температурах - криптохимии.
Итак, энергия активации - это энергия необходимая для перехода частиц в состояние активированного комплекса. С ростом температуры растёт доля этих частиц и скорость реакции. С увеличением энергии активации уменьшается доля активных молекул и скорость реакции.
Химическое равновесие
При некоторой температуре энтальпийный и энтропийный факторы уравниваются, т.е. ![]() в этом случае выполняется уравнение:
в этом случае выполняется уравнение:
![]() (5.17)
(5.17)
которое является термодинамическим уравнением химического равновесия. В условиях химического равновесия концентрации (или парциальное давление для газов) исходных веществ и продуктов реакции не изменяеться со временем и называются равновесными концентрациями.
Константа химического равновесия.
при равновесной химической реакции:
![]()
![]() (5.22)
(5.22)
или
![]() (5.23)
(5.23)
![]() - равновесные относительные
- равновесные относительные
![]() -равновесные концентрации соответствующих веществ
-равновесные концентрации соответствующих веществ
l,m,d,b- показатели степени, равные стехиометрическим коэффициентам.
![]() (5.24)
(5.24)
![]() (5.25)
(5.25)
Закон действующих масс: отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентрация исходных веществ в степенях, равных стехиометрическим коэффициентам, при T=const, является величиной постоянной.
![]()
![]()
или
![]()
для газов
![]() (5.26)
(5.26)
подставляя константу равновесия:
![]() (5.27)
(5.27)
![]() (5.28)
(5.28)
При 298 К ![]() . Уравнение (5.27) можно записать в виде:
. Уравнение (5.27) можно записать в виде: ![]() (5.29)
(5.29)
Константа химического равновесия может быть определенна если известно стандартное значение энергии Гиббса.
Принцип Ле Шетелье:
Если на систему, находящуюся в равновесии, оказываеться внешнее воздействие, то равновесие смещается в таком направлении, которое
ослабляет внешнее воздействие.
Например увеличение температуры вызывает смещение равновесия рассматриваемой реакции получения водорода ![]() в правую сторону, а для экзотермической реакции:
в правую сторону, а для экзотермической реакции:
![]()
Смотрите также
Заключение
В соответствии с поставленной целью выпускной
работы – формирование умений пользоваться химическим языком – было сделано
следующее:
Проанализировано состояние проблемы методики
формирования уме ...
Ионообменная хроматография
В ионообменной хроматографии
разделение компонентов смеси достигается за счет обратимого взаимодействия
ионизирующихся веществ с ионными группами сорбента. Сохранение
электронейтральности с ...
Фтор (Fluorum), F
Фтор - химический элемент VII группы периодической системы Менделеева, относится к галогенам, атомный номер 9, атомная масса 18,998403; при нормальных условиях (0 °C; 0,1 Мн/м2, или 1 кгс/см2) - г ...
