Химическая кинетикаМатериалы / Химическая кинетикаСтраница 5
![]() (7.26)
(7.26)
v2 и v1 скорости реакций при температурах Т2 и Т1, Y коэффициент, значение которого для эндотермической реакции выше, чем для экзотермической реакции. Для многих реакций Y лежит в пределах 2-4.
Уравнение (7.26) можно использовать лишь для ориентировочных расчётов, так как их точность не очень высока.
Уравнение Аррениуса.
![]() (7.27)
(7.27)
k - константа скорости реакции
k - предэкспоненциальный множитель
e - основание натурального логарифма
E - постоянная, называемая энергией активации, определяемая природой реакции. Значения Ea для химических реакций лежат в пределах 40-400 кДж/моль.
Если при изменении температуры концентрация реагентаостаёся постоянной, то зависимость скорости реакции от температуры описываеться уравнением:
![]()
Где Ea =0, Vo=V
Уравнение (7.27) можно представить в виде
![]() (7.28)
(7.28)
или
![]() (7.28б)
(7.28б)
Графическое изображение уравнения (7.28б) приведено на рис 7.2.

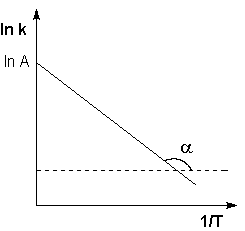
(рис 7.2 зависимость логарифма константы скорости от обратной температуры по уравнению аррениуса)
Как видно из уравнения (7.28б) и рис (7.2)
![]()
Уравнение Аррениуса озволяет проводить более точные расчеты изменения скорости реакции с увеличением температуры, чем уравнение (7.26). Приведём уравнение Аррениуса для двух температур:
![]()
![]()
Вычитая из второго уравнения первое, получаем
![]() (7.29а)
(7.29а)
![]() (7.29б)
(7.29б)
По уравнениям (7.29аб) можно рассчитать отношение констант скоростей реакции при двух температурах, если известно Ea, или энергию активации, если известно соотношение констант скоростей реакции при двух температурах.
Аналогичное уравнение можно вывести и из скоростей реакции:
![]() (7.30)
(7.30)
Из уравнений (7.26) и (7.29) следует, что ![]() и
и ![]() .
.
![]()
Итак, константа скорости реакции ( а при постоянных концентрациях и скороть реакции) возрастает с увеличением температуры по экспоненциальному закону. В соответсвии с уравнением Аррениуса константа скорости реакции уменьшаеться с ростом энергии активации. Из уравнения Аррениуса также следуе, что чем выше энергия активации, тем выше градиент скорости реакции по температуре. Уравнение Аррениуса позволяет рассчитывать константы скорости (и скорости) реакции при различных температурах.
Энергия активации
В ходе химической реакции разрушаются одни и возникают другие молекулы и соединения, происходит изменение химических связей, т.е. перераспределение электронной плотности. Если бы старые химические связи в ходе реакции сразу полностью разрушались, то на это потребовалось бы большое количество энергии и реакция протекала крайне медленно. Как показали исследования, в ходе реакции система проходит через переходное однородное состояние через образование, так называемого, активированного комплекса.
Например: AB+DC=AD+BC можно представить как:
A-B A…B A B
+ -> . . -> | |
D-C C…D D C
исх в-во акт.комп. прод. р-ии
В активированном комплексе старые связи еще не разрушены, но ослаблены, новые связи наметились, но не образованны. В результате образуется либо новое вещество, либо исходное. Система в переходном состоянии имеет более высокую энергию, чем в исходном и конечном состояниях.
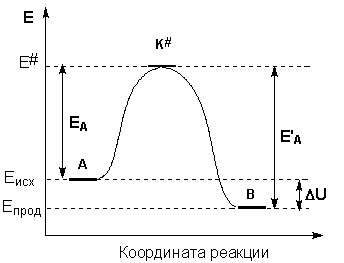
(рис 7.3) энерг. диаграмма хода реакции
Энергия необходимая для перехода вещества в состояние активного комплекса - энергия активации.
Смотрите также
Моделирование парожидкостного равновесия реакционной смеси в процессе получения
Метилциклопропилкетон (МЦПК) – важный
полупродукт органического синтеза. Одним из способов его получения является
реакция разложения ацетопропилацетата с выделением уксусной кислоты (УК) [1] ...
Поливинилпирролидон:
его применение и важнейшие характеристики
Поливинилпирролидон является виниловым полимером. В основном его получают
методом радикальной виниловой полимеризации из мономера винилпирролидона. ...
Проблемы государственного регулирования нефтяного комплекса России в условиях рынка
...
