Энергетика химических реакцийМатериалы / Энергетика химических реакцийСтраница 3
При термохимических расчётах важными являются ![]() (
(![]() ) – это тепловой эффект реакций образования вещества из простых веществ. По величинам и знакам энтальпии можно судить об устойчивости соединения относительно его распада на простые вещества.
) – это тепловой эффект реакций образования вещества из простых веществ. По величинам и знакам энтальпии можно судить об устойчивости соединения относительно его распада на простые вещества.
Если ![]() , то соединение более устойчиво, чем простые вещества, из которых оно образовано. Стандартный тепловой эффект химической реакции равен сумме стандартных энтальпий образования продуктов реакций за вычетом суммы стандартных энтальпий образования реагентов с учётом стехиометрических коэффициентов:
, то соединение более устойчиво, чем простые вещества, из которых оно образовано. Стандартный тепловой эффект химической реакции равен сумме стандартных энтальпий образования продуктов реакций за вычетом суммы стандартных энтальпий образования реагентов с учётом стехиометрических коэффициентов: ![]()
![]()
![]() =[Дж/моль]
=[Дж/моль]
![]() – эндотермический процесс,
– эндотермический процесс, ![]() – экзотермический процесс
– экзотермический процесс
![]() – для простых веществ
– для простых веществ
С термохимическими уравнениями можно проводить любые математические действия.
3) ![]()
1) ![]()
![]()
2) ![]()
![]()
![]()
![]()
![]() – по закону Гесса
– по закону Гесса
Тепловой эффект изменяется с изменением температуры в соответствии с законом Кирхгофа: 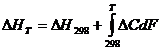 ,
,
где ![]() – разность между ∑ теплоёмкостей продуктов реакций за вычетом реагентов.
– разность между ∑ теплоёмкостей продуктов реакций за вычетом реагентов.
Теплоёмкость ![]() , которая необходима для нагревания определённого количества вещества на 1К, если относится к 1 молю – молярная, к 1 кг – удельная.
, которая необходима для нагревания определённого количества вещества на 1К, если относится к 1 молю – молярная, к 1 кг – удельная.
при ![]()
![]() при
при ![]()
![]()
IV. Реакцию, идущую саму по себе (без помощи извне) называют самопроизвольной.
Некоторые самопроизвольные реакции являются эндотермическими.
![]()
![]()
![]()
![]()
![]() Ne Ar
Ne Ar
Два газа разделены перегородкой, если ее убрать начнется самопроизвольный процесс взаимодиффузии. Система, состоящая из различных молекул, в разных сосудах более упорядочена, чем смесь разных молекул в одном сосуде, т.е. все самопроизвольные изменения заключаются в переходе из упорядоченного состояния частиц в менее упорядоченное. Степень беспорядка или неупорядоченность в системе характеризуется состоянием системы называемом энтропией.
Энтропия – функция меры беспорядка ![]() , она связана с термодинамической вероятностью реализации данного состояния вещества:
, она связана с термодинамической вероятностью реализации данного состояния вещества:
![]() , где
, где
![]() – постоянная Больцмана,
– постоянная Больцмана,
![]() – термодинамическая вероятность, т.е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
– термодинамическая вероятность, т.е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
![]() – стандартная энтропия,
– стандартная энтропия, ![]() – её изменение.
– её изменение.
В изолированных системах изменение энтропии служит критерием определяющим направление процесса.
Смотрите также
Теория хроматографии, хроматографический анализ, виды хроматографии
...
Медь
Медь в латинском языке — Cuprum.
Это один из известнейших химических элементов, этот металл известен с глубокой
древности.
По данным археологической науки
медь была хорошо известна егип ...
Твердофазные потенциометические сенсоры, селективные к ванадий и вольфрамсодержащим ионам
...
