ТитрованиеСтатьи / ТитрованиеСтраница 1
Работа 1. Окислительно-восстановительное титрование.
Цель работы: знакомство с методом титрования; используя метод титрования определить концентрацию перманганата калия в 5 см3 данного для работы раствора.
Титрование
– метод количественного анализа, позволяющий определить неизвестную концентрацию вещества в растворе, исходя из объема другого раствора и концентрации вещества в нем. Необходимое условие: в растворах разные вещества и они реагируют между собой. Требования к реакции:
* практически необратима;
* момент окончания химического взаимодействия (точка эквивалентности) хорошо определим;
* реакция идет быстро, почти мгновенно;
* на протекание реакции практически не оказывают влияния изменения внешних условий.
Приборы и материалы.
Оборудование:
Лабораторный штатив – 2 шт; спиртовка – 1 шт; муфта – 2 шт; двупалая лапка – 1 шт; кольцо – 1 шт; астбестированная сетка – 1 шт; бюретка для титрования (рис.1) – 1 шт; химический стакан – 1 шт.
Материалы:
0,05 Н раствор щавелевой кислоты (рабочий раствор); раствор перманганата калия (титруемый раствор).
Химические реагенты.
Исходные вещества:
 - щавелевая кислота; KMnO4 – перманганат калия; H2SO4 – серная кислота
- щавелевая кислота; KMnO4 – перманганат калия; H2SO4 – серная кислота
Продукты реакции:
CO2 – углекислый газ; K2SO4 – сульфат калия; MnSO4 – сульфат марганца (II), H2O – вода.
Подготовка к работе.
1. Приготовить 0,05Н раствор щавелевой кислоты;
2. Промыть бюретку;
3. Собрать установку (см. рис.2), проверить, стоит ли бюретка вертикально;
4. Заполнить бюретку приготовленным раствором щавелевой кислоты до отметки 0 (удалить пузырь из носика бюретки!);
5. Раствор перманганата калия слить в химический стакан, подкислить его серной кислотой.
6. Приступить к работе.
(Дополнительно:
1. При проведении стандартной серии титрований всегда аккуратно доливать рабочий раствор в бюретку точно до отметки 0.
2. Концентрация вещества в рабочем растворе должна быть равной во всем объеме раствора.)
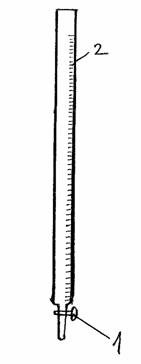
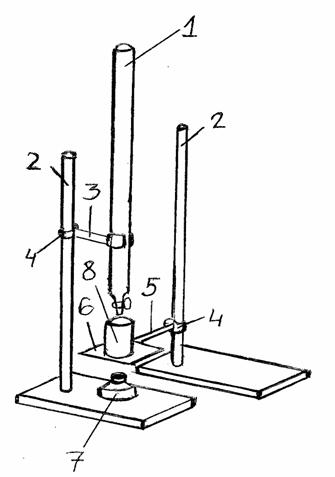
Рис.1 Бюретка Рис.2 Установка для титрования.
Рис.1
1 – кран, 2 – шкала делений.
Рис.2
1 – бюретка, 2 – штативы, 3 – двупалая лапка, 4 – муфты, 5 – кольцо, 6 – астбестированная сетка, 7 – спиртовка, 8 – химический стакан.
Ход работы.
Химический стакан с анализируемым раствором перманганата калия, подкисленный серной кислотой, ставят на астбестированную сетку. Зажигают спиртовку. Далее у готовой к работе бюретки с раствором щавелевой кислоты открывают кран и аккуратно, порциями, приливают его к раствору перманганата калия. Химический стакан с раствором должен хорошо прогреваться, для избежания сливания лишнего количества рабочего расвора. Раствор в химическом стакане медленно обесцвечивается. Чтобы избежать перетитровывания (сливания избытка рабочего раствора), на последнем этапе следует приливать рабочий раствор по каплям. Когда изменение окраски раствора в химическом стакне прекратится, титрование прекращают. Фиксируют слитый объем раствора щавелевой кислоты. Производят расчет концентрации перманганата калия в анализируемом растворе.
Расчет концентрации.(Пример рассчета)
На титрование 5 см3 раствора перманганата калия израсходовали 0,29 см3 0,05Н раствора щавелевой кислоты. Определить концентрацию перманганата калия в исходном растворе.
Уравнение реакции:
5C2H2O4 + 2KMnO4 + 3H2SO4 = 10CO2↑ + K2SO4 + 2MnSO4 + 8H2O
C2III – 2e = 2CIV 5 Red
MnVII + 5e = MnII 2 Ox
Рассчет:
5 см3 = 0,005 дм3; 0,29 см3 = 0,00029 дм3; 1 моль KMnO4 – 5 г-экв KMnO4; 1 моль C2H2O4 – 2 г-экв C2H2O4
с(KMnO4) = [0.00029cm3 * 0.05H * 1mol/2g-ekv * 2 / 5] / 0.005dm3 = 0.00058M
Для упрощения рассчета часто пользуются отношением: V1/V2 = H2/H1 (V1,V2 – объемы растворов, H2,H1 – нормальности растворов). Подставим известные данные и найдем нормальность раствора перманганата калия:
Н(KMnO4) = [0.00029dm3 * 0.05H] / 0.005dm3 = 0.0029H
1 г-экв KMnO4 – 1/5 моль KMnO4, следовательно 0.0029H/5 = 0,00058М (т.е. то же самое, что получилось по первому методу)
Сущность химического взаимодействия.
Исходные вещества диссоциируют в водном растворе:
C2H2O4 ↔ 2H+ + C2O42-
KMnO4 ↔ K+ + MnO4-
H2SO4 ↔ 2H+ + SO42-
Перманганат-ион в кислой среде восстанавливается по схеме:
Смотрите также
Результаты и обсуждения
Цель работы:
1)
Исследование
комплексообразования кальция с поливинилпирролидоном различными
ф ...
Лантаноиды
Лантаноиды (от лантан и греч. еidos - образ, вид), лантаниды, семейство из 14 химических элементов с атомным номером от 58 до 71, расположенных в 6-м периоде системы Менделеева вслед за лантаном (табл ...
