Прогнозирование энтальпии образования при нормальных и повышенных давленияхСтатьи / Прогнозирование энтальпии образования при нормальных и повышенных давленияхСтраница 1
Прогнозирование ![]() органических соединений
органических соединений
При прогнозировании энтальпий образования органических веществ, находящихся при давлении 1 атм и температуре выше 298 К, используются:
* значение ![]() вещества, вычисленное любым из аддитивных методов или взятое из справочников;
вещества, вычисленное любым из аддитивных методов или взятое из справочников;
* сведения о температурной зависимости теплоемкости вещества в виде аппроксимирующего уравнения или в табулированной форме;
* сведения о температурной зависимости теплоемкости простых веществ или элементов, которыми представлено данное вещество, в виде аппроксимирующего уравнения или в табулированной форме (прил. 3);
* уравнение Кирхгофа (1.1)
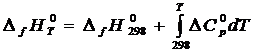 , (1.1)
, (1.1)
где ![]() - разность между теплоемкостями соединения и простых веществ или элементов, которыми представлено данное вещество, причем каждый элемент или простое вещество находится в своем стандартном состоянии (как указано выше) и теплоемкость каждого умножается на соответствующий стехиометрический коэффициент в реакции образования вещества из элементов или простых веществ. Сведения о теплоемкостях простых веществ приводятся в табл. прил. 3. Процедура расчета
- разность между теплоемкостями соединения и простых веществ или элементов, которыми представлено данное вещество, причем каждый элемент или простое вещество находится в своем стандартном состоянии (как указано выше) и теплоемкость каждого умножается на соответствующий стехиометрический коэффициент в реакции образования вещества из элементов или простых веществ. Сведения о теплоемкостях простых веществ приводятся в табл. прил. 3. Процедура расчета ![]() рассмотрена в примере 1.2, при этом использованы справочные данные для теплоемкостей вещества, поскольку вопросы прогнозирования
рассмотрена в примере 1.2, при этом использованы справочные данные для теплоемкостей вещества, поскольку вопросы прогнозирования ![]() обсуждаются позже (разд. 3 данного пособия).
обсуждаются позже (разд. 3 данного пособия).
Пример 1.2
Рассчитать ![]() циклогексана при 400, 500 и 600 К. Энтальпия образования
циклогексана при 400, 500 и 600 К. Энтальпия образования ![]() циклогексана составляет –123,34 кДж/моль [1], значения теплоемкостей
циклогексана составляет –123,34 кДж/моль [1], значения теплоемкостей ![]() при 400, 500 и 600 К заимствованы из [1] и приведены в табл. 1.12.
при 400, 500 и 600 К заимствованы из [1] и приведены в табл. 1.12.
Решение
С использованием уравнения Кирхгофа вычисляются энтальпии образования циклогексана при интересующих температурах. При этом средние величины теплоемкостей циклогексана, углерода и водорода в любом из интервалов температур (от 300 до 400 К, от 400 до 500 К, от 500 до 600 К) считаются величинами постоянными по условию создания таблиц, допускающих линейную интерполяцию соседних значений в них.
Таблица 1.12
|
кДж/моль [1] |
Теплоемкость, |
кДж/моль |
% отн. | ||||
|
Т, К |
Циклогексан |
Углерод (графит) |
Водород (Н2) | ||||
|
300 |
107,03 |
8,72 |
28,85 | ||||
|
400 |
-134,10 |
149,87 |
11,93 |
29,18 |
-134,32 |
0,13 | |
|
500 |
-142,59 |
190,25 |
14,63 |
29,26 |
-142,81 |
0,15 | |
|
600 |
-148,84 |
225,22 |
16,86 |
29,32 |
-149,06 |
0,15 | |
Смотрите также
Кальцинация гидрокарбоната
...
Осмий (Osmium), Os
Попробуйте подсчитать, какой путь совершает кончик пера автоматической ручки при движении по бумаге только в пределах одной тетради в 12 листов. Пусть это будет зависеть от величины букв, манеры письм ...
