Коррозионное и электрохимическое поведение меди.Периодическая система / Коррозия меди в 5М изопропанольных растворах НС1 / Коррозионное и электрохимическое поведение меди.Страница 5
Очевидно, что с увеличением цепи алкильной группы возрастают стерические затруднения протекания этой реакции, так что скорость образования комплекса в ряду метанол ® этанол ® пропанол снижается.
Процесс анодного растворения меди определяется как свойствами анионов фона, так характером растворителя. Оба эти фактора влияют на диффузию ионов меди. Происходит также взаимодействие между молекулами растворителя и анионами.
Кинетика анодной ионизациии меди в системе изо-С3Н7ОН–Н2О–НС1, как функция природы растворителя (0,2-10 мас.% воды), ионной силы раствора (1-3), потенциала электрода, гидродинамических условий в приэлектродном слое и характера атмосферы изучена в [[xiv]]. Показано, что предварительное насыщение рабочего раствора кислородом не оказывает влияния на ход анодных поляризационных кривых. С учетом межфазного потенциала определены порядки реакции анодной ионизации меди по ионам водорода и хлора. Тафелевский наклон анодных кривых во всех случаях близок к 60 мВ. В растворе с содержанием Н2О 0,2% nH+=1 или 2, а nС1- близок к единице (ионная сила 1 и 2) и двум (ионная сила 3). В смешанном водно-спиртовом растворителе во всех случаях nH+=0 , nС1- =2.
На основе полученных кинетических параметров предложен механизм анодного растворения меди в исследуемых условиях можно представить в виде следующего двухстадийного процесса с последней лимитирующей стадией:
Сu + mH+C1– « 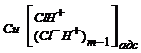 + е (33а)
+ е (33а)
Сu + mC1– « Cu(C1![]() )-адс + е (33б)
)-адс + е (33б)
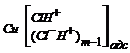
![]() ® CuC1
® CuC1![]() + mH+ (34а)
+ mH+ (34а)
Cu(C1![]() )-адс ® CuC1
)-адс ® CuC1![]() (34б)
(34б)
Порядок реакции по ионам водорода равен n, где 0<n<m и m принимает значения 1 или 2 при участии в процессе ионных пар или только 2, когда основную роль в анодной реакции играют ионы С1–, т. к. образование частиц СuC1 в силу малой растворимости хлорида меди (I) должно вести к солевой пассивности меди, но экспериментально этого не наблюдается. Тогда суммарное кинетическое уравнение запишется следующим образом:
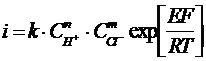 (35)
(35)
Если ионные ассоциаты не принимают участия в анодном процессе (схема (33б-34б), то n=0, если же реакция протекает только с участием ионных асcоциатов, которые представлены в виде ионных двойников, то n=m.
В [[xv]] указывается на то, что известные для водных сред ингибиторы коррозии меди ( бензотриазол (БТА), тиомочевина, никотиновая кислота [[xvi]]) только не оказывают ингибирующего действия, но даже вызывают увеличение скорости коррозии в 1М изопропанольных растворах НС1.
* * *
Подводя итог обзору литературных данных по коррозионному и электрохимическому поведению меди можно отметить следующее. Как в водных, так и в неводных, в частности, хлоридных спиртовых средах медь переходит в раствор в виде однозарядных ионов, образуя комплексные соединения. В органических растворителях дополнительная устойчивость Cu+ обусловлена высоким значением энергии их сольватации.
В присутствии собственных двухвалентных ионов наблюдается параллельное протекание наряду с электрохимическими процесса коррозии меди и химической реакции репропорционирования на поверхности электрода, доля которой весьма значительна в неводных растворителях и составляет лишь несколько процентов в кислых водных средах.
Природа спирта, в целом, не вносит принципиального изменения в электрохимическое поведение меди. В то же время, не вполне ясно, будут ли наблюдаться те же закономерности и в спиртовых растворах с высоким содержанием хлороводорода, значительно чаще применяющихся в органическом синтезе . Цель настоящей работы состоит в выяснении характера влияния ионов Cu2+ на коррозия меди в 5М безводных изопропанольных растворах НС1 а также в выявлении роли воды в смешанном водно-спиртовом растворителе.
Смотрите также
Получение сорбционных материалов с биогенными элементами
...
Химические способы нанесения металлических покрытий
Металлические
слои можно получать на очень большом числе самых разнообразных материалов,
таких, как стекло, кварц, фарфор, слюда, целлулоид, а также текстиль. Насколько
многочисленны примен ...
Исследование диэлектрической релаксации в полимерных полувзаимопроникающих сетках
Поиск полимерных материалов с
модифицированным комплексом физических свойств ведет к использованию различного
рода композиционных систем, в которых важным фактором регулирования свойств
явл ...
