Комплексы. Связи координационная, дативная. Обратное связываниеПериодическая система / Комплексы. Связи координационная, дативная. Обратное связываниеСтраница 1
Комплексы. Связи координационная, дативная. Обратное связывание (универсальное !).
Комплексные соединения. Координационная связь. Дативная связь. Валентная конфигурация центрального атома металла 3d104s24p6. Правило «18 электронов» (Правило устойчивости комплексов).
Валентные эффекты в координационных соединениях очень наглядны на примере карбонилов переходных металлов. Имеется превосходная возможность для сравнения молекулы оксида углерода в свободном состоянии и в виде лиганда в комплексах.
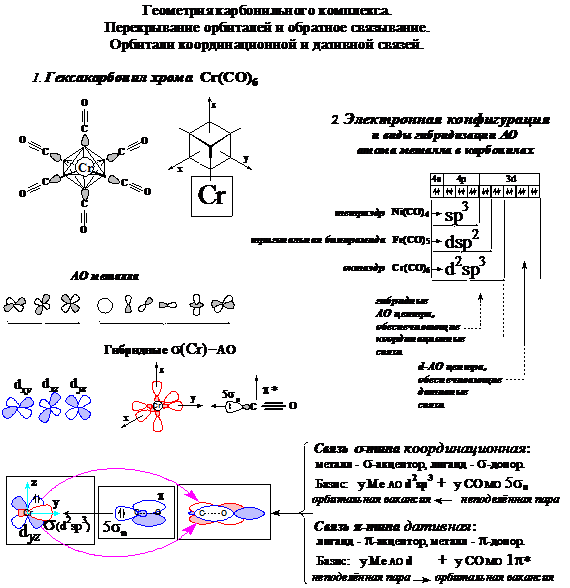
Карбонилы переходных металлов. Cr(CO)6; Fe(CO)5; Ni(CO)4;
О взаимном расположении уровней АО в молекуле говорить в строгом смысле сложно, – они имеют статус лишь базисных единиц, а не волновых функций в строгом смысле. Тем не менее, валентная конфигурация центрального атома металла в каждом из этих трёх карбонилов может быть представлена в виде 3d104s24p6 в условном порядке увеличения главного квантового числа.
Если последовательность уровней этих базисных АО связать с увеличением числа узлов и лепестков, то конфигурация принимает вид 4s24p63d5. На шкале молекулярных уровней энергии связывающие s-орбитали лежат ниже, и поэтому нагляднее схема
| 4s | 4p | 3d | ||||||
|
¯ |
Ї |
Ї |
Ї |
Ї |
Ї |
Ї |
Ї |
Ї |
В неё включены все электроны валентного слоя центрального атома и валентные электроны лигандов. У выступающей в качестве лиганда молекулы CO эту роль играет неподелённая электронная пара 5sn2, заселяющая несвязывающую ВЗМО. Часть электронов относится к обеспечивающим s-связывание гибридным орбиталям центрального атома, форма которых определяется максимальным перекрыванием с орбиталями лигандов.
Наиболее эффективна гибридизация с участием s-АО. Учитывая s-АО в составе гибрида, получаем разные числа смешивающихся базисных АО центрального атома у каждого из трёх карбонилов. Оставшиеся вне гибрида 3d-АО центрального атома обеспечивают перекрывание p-типа с лигандами.
Связывающие и разрыхляющие МО лигандов. Частоты колебаний связи CO.
Обратное связывание металл-лиганд на примере карбонилов.
Пиктографическая схема обратного связывания.
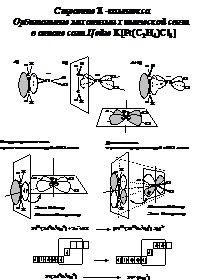

Cr¬C=O Гибридизация АО и соединения платины:
PtCl2; PtCl4; [PtCl4]2-; [Pt(NH3)2]2-; [PtCl6]2-;
PtCl4(NH3)2; [Pt(CO)4]2+; [Pt(CN)4]2-; PtF62-;
Геометрия аниона соли Цейзе: K+[PtCl3(C2H4)]- :
Молекула этена ориентирована перпендикулярно плоскости аниона.
Наблюдается обратное связывание.
Платина p-донор, s-акцептор. Этен
p-акцептор на разрыхляющую p*-МО,
но s-донор на dsp2-гибридную s-АО платины.
Методы ионизационной фотоэлектронной спектроскопии (ФЭС-РЭС) дают возможность прямого экспериментального исследования орбитальных уровней МО, а также и заселённостей АО базиса.
В основе метода лежит фотоэффект, независимо открытый Столетовым и Герцем. Идея построения ионизационного спектрометра принадлежит нашему фотохимику академику Теренина.
Смотрите также
Соединения, изолируемые перегонкой с водяным паром: кетоны - ацетон
Свойства и применение ацетона
Ацетон
Синонимы: Диметилкетон, 2-пропанон
...
Задание 1
1. Как одним реагентом различить водные растворы HBr, NaF, KOH, AlCl3?
Напишите уравнения соответствующих реакций и укажите их признаки.
1.
Н ...
