СвойстваПериодическая система / Комплексы палладия / СвойстваСтраница 1
Палладий образует хлорокомплексы, в которых проявляет степени окисления +2 и +4. В хлоридных растворах он обычно присутствует в виде хлорокомплексов палладия(II), а также продуктов их акватации и гидролиза. Хлорокомплексы палладия(II) в водных растворах акватируются и гидролизуются легче, чем комплексы других платиновых металлов.
В зависимости от концентрации ионов H+ и Сl- в растворах могут образовываться комплексы состава [Pd(H2O)nCl4-n]n-2, где n может изменяться от 0 до 3 (CPd 10-6 – 10-2 М. В растворах HCl и NaCl с концентрацией Cl- 1 М доминирует форма [PdCl4]2-, а при 0.1 CCl- 0.5 М сосуществуют комплексные ионы [PdCl4]2- и [Pd(H2O) Cl3]- Если соотношение Pd(II): Cl – равно 1:1, в растворе доминирует [Pd(H2O) Cl3]-, при отношении 1:10 – в растворе находится смесь комплексов: [Pd(H2O)3Cl]+, [Pd(H2O)2Cl2]0, [Pd(H2O) Cl3]- и [PdCl4]2- Ион [PdCl4]2 – преимущественно присутствует в растворах 1 – 3 М HClO4 или 3 М H2SO4 при концентрации хлорид-иона 0.1 – 1 М.
Предполагается, что анодное растворение палладия постоянным током в растворах НCl сопровождается образованием ионов [Pd(H2O) Cl3]- и [PdCl4]2-]. Легкость, с которой палладий под действием тока переходит в солянокислые растворы, объясняют тем, что выделяющийся на аноде хлор реагирует с палладием и способствует, таки образом, его растворению.
При добавлении щелочи к водным растворам Na2[PdCl4] образуются продукты, представляющие собой полиядерные комплексы, содержащие OH- и H2O – лиганды, либо они являются коллоидными частицами гидроксида Pd(II). В растворах Na2[PdCl4] при рН 3 образуются малорастворимые продукты гидролиза.
Амминокомплексы образуются в процесах аффинажа, например, плоскоквдратный комплекс состава [Pd(NH3)2Cl2]. Комплекс транс-строения характеризуются крайне низкой растворимостью в воде, благодаря чему используется для количественного выделения палладия из растворов аффинажного производства (см. раздел 5).
Основные химические реакции σ -комплексов: 1) термическое разложение соединения типа [Pd(R2)L2] (R = СН3, С2Н5, С3Н7) с образованием углеводородов R—R или олефинов (при RСН3); 2) расщепление связи Pd—С при действии кислот, галогенов, окислителей, комплексных гидридов металлов; 3) реакции внедрения лигандов по связи Pd—С (важны в каталитических реакциях образования связи С—С); 4) легкое замещение лигандов X, находящихся в транс-положении к R в палладийорганических соединениях типа [PdX(R)L2], напр.:
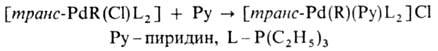
Основные хим. реакции π-комплексов: 1) обмен атома Сl на другие лиганды; реакции могут протекать с сохранением димерной структуры (напр., при замене на Вг или I) или с разрывом галогеновых мостиков (напр., при действии циклопентадиенидов и ацетилацетонатов Na или Тl, фосфи-нов и другие подобных реагентов); в последнем случае образуются мономерные комплексы [Pd(-аллил) (-С5Н5)], [Pd(-аллил) асас](асас - ацетилацетонат анион); 2) разрыв связи Pd—аллил при окислении с образованием ненасыщ. карбонильных соединения, при восстановлении с образованием моноолефинов и насыщ. соединения, а также при действии галогенов, оснований и другие; 3) реакции переноса аллильного лиганда на другие металлы, напр.:
![]()
4) в присутствии донорных лигандов или при повышенной температуре многие аллильные комплексы Pd претерпевают динамические перегруппировки, включающие -переходы аллильного лиганда.
η5-С5Н5-лиганд легко отщепляется при действии различных реагентов, напр.:
![]()
Трехъядерный ацетат палладия(II) сам по себе мало реакционноспособен, и для вступления в реакцию (1) требуется его активация. Методом 1H ЯМР было обнаружено что в органических растворителях (хлороформ, бензол) по крайней мере один из ацетатных мостиков в молекуле Pd3(µ-OOCMe)6 легко подвергается гидролитическому разрыву. При этом одна из шести ацетатных мостиковых групп становится монодентатным лигандом, а образовавшуюся координационную вакансию занимает молекула H2O [5].
Смотрите также
Стронций и рубидий. Сравнительный анализ свойств
Рубидий и стронций стоят
рядом в Периодической таблице Д. И. Менделеева, а значит, имеют сходные
свойства. Однако, один является щелочным металлом, а другой щелочноземельным. И
своим вн ...
Тепловой эффект химической реакции
Тепловые
эффекты химических реакций необходимы для многих технических расчетов. Они
находят обширное применение во многих отраслях промышленности, а также в
военных разработках.
Целью
д ...
Палладий (Palladium), Pd
Открыт английским химиком Вильямом Волластоном (William Hyde Wollaston) в 1803 году. Волластон выделил его из платиновой руды привезённой из Южной Америки.
Для выделения элемента Волластон растворил ...
