Степень
окисления +4Материалы / Химические соединения на основе кремния и углерода / Степень
окисления +4
Диоксид углерода С02 (углекислый газ). Молекула С02 линейна. Энергетическая схема образования орбиталей молекулы С02 приведена на рис.2. Оксид углерода (IV) может взаимодействовать с аммиаком по реакции.
![]()
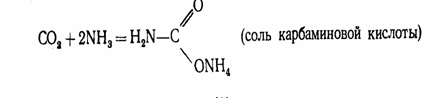
При нагревании этой соли получают ценное удобрение - карбамид СО (МН2) 2:
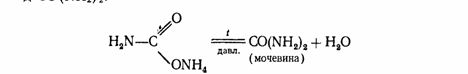
Мочевина разлагается водой
CO (NH2) 2+2HaO= (МН4) 2СОз.
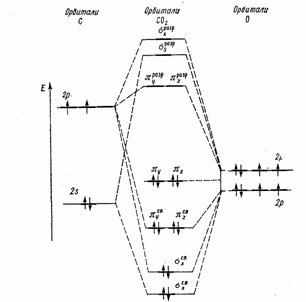
Рисунок 2. Энфгетическая диаграмма образования молекулярных орбиталей С02.
В технике оксид СО2 получают разложением карбоната кальция или гидрокарбоната натрия:
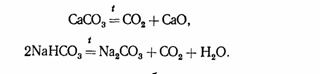
В лабораторных условиях его обычно получают по реакции (в аппарате Киппа)
СаСОз+2НС1=СаС12+С02+Н20.
Важнейшими производными С02 являются слабая угольная кислота Н2СОз и ее соли: MI2СОз и MIНСОз (карбонаты и гидрокарбонаты соответственно).
Большинство карбонатов нерастворимо в воде. Растворимые в воде карбонаты подвергаются значительному гидролизу:
![]()
![]() COз2-+H20 COз-+OH - (I ступень).
COз2-+H20 COз-+OH - (I ступень).
Из-за полного гидролиза из водных растворов нельзя выделить карбонаты Cr3+, ai3+, Ti4+, Zr4+ и др.
Практически важными являются Ка2СОз (сода), К2СОз (поташ) и СаСОз (мел, мрамор, известняк). Гидрокарбонаты в отличие от карбонатов растворимы в воде. Из гидрокарбонатов практическое применение находит NaHCО3 (питьевая сода). Важными основными карбонатами являются 2СиСОз-Си (ОН) 2, РЬСО3 Х ХРЬ (ОН) 2.
Свойства галогенидов углерода приведены в табл.6. Из галогенидов углерода самое большое значение имеет-бесцветная, достаточно токсичная жидкость. В обычных условиях ССІ4химически инертен. Его применяют как невоспламеняющийся и негорючий растворитель смол, лаков, жиров, а также для получения фреона CF2CІ2 (Ткип= 303 К):
![]()
Другой используемый в практике органический растворитель - сероуглерод CSa (бесцветная, летучая жидкость с Ткип=319 К) – реакционно способное вещество:
CS2+302=C02+2S02+258 ккал/моль,
CS2+3Cl2=CCl4-S2Cl2,CS2+2H2 0==C02+2H2S, CS2+K2S=K2CS3 (соль тиоугольной кислоты Н2СSз).
Пары сероуглерода ядовиты. [8,463-464]
Смотрите также
Классификация химических реакций
Самое интересное в окружающем мире состоит в
том, что он постоянно изменяется.
Понятие «химическая реакция» - второе
главное понятие химии. Каждую секунду в мире происходит неисчислимое ...
Углерод (С)
Углерод
(Carboneum), С - химический элемент IV группы, побочной подгруппы, 2-го
периода периодической системы Д. И. Менделеева, порядковый номер 6.
Относительная атомная масса: 12,011. Элек ...
Гафний (Hafnium), Hf
Гафний - химический элемент IV группы периодической системы Менделеева; порядковый номер 72, атомная масса 178, 49; серебристо-белый металл. В состав природного Г. входят 6 стабильных изотопов с массо ...
