2. Уравнения электрохимической кинетики, пределы их применимостиКниги / Физическая химия / ЛЕКЦИЯ № 13. Электрохимическая кинетика / 2. Уравнения электрохимической кинетики, пределы их применимостиСтраница 2
α– коэффициент переноса для катодной реакции;
(1 – α) – для анодного процесса (коэффициент переноса).
ΔGk = ZFE α, (4)
ΔGA = ZFE(1 – α) (5)
С учетом уравнений (4), (5) уравнения (2), (3) примут следующий вид:
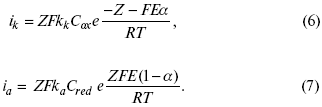
Различие знаков у электрона объясняется тем, что катодная поляризация («–») ускоряет прямую реакцию и замедляет обратную реакцию.
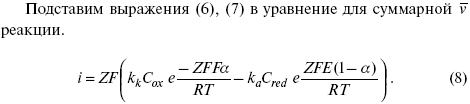
Введем в уравнение (8) плотность тока обмена – i 0.
![]()
Вместо потенциала введем перенапряжение:
![]()
полное уравнение поляризационной кривой.
Вывод из уравнения (10):
1) при равновесном потенциале, когда ток равен нулю, уравнение (10) преобразуется в уравнение Нернста:
![]()
2) при малых величинах η:
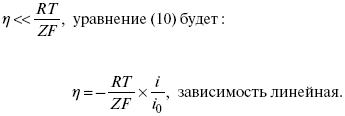
При сдвижении потенциала от равновесного (59 m В);
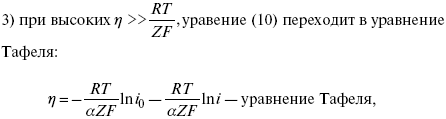
η = a + b ln i – уравнение Тафеля в простом виде при замедлении стадии переноса заряда.
Величина i 0 (тока обмена) и α (коэффициента переноса) – основные кинетические параметры стадии переноса заряда (q). Они могут быть определены из экспериментальных измерений, для этого на исследуемом электроде снимают зависимость η– i или Ei – i.
Поляризационная кривая судит о коррозионной стойкости металлов.
Перестраиваем поляризационную кривую в координаты:
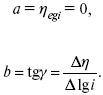
Определяем const а и b в уравнении Тафеля, определяем b:
Из коэффициента b найдем а, после подставим в а и найдем i 0.
Перенапряжение Н2 (водорода).
Источник выделения Н2 – Н2SO4→
Н++ НSO4–
Источник выделения Н2 – Н2О →
Н++ ОН-.
В рН < 7 Н2 выделяется по реакции.
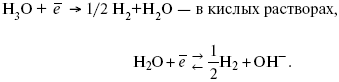
Н2 всегда выделяется в потенциалах более отрицательных, чем равновесный потенциал, то есть с перенапряжением.
Суммарный процесс выделения водорода состоит из следующих стадий:
1) доставка к поверхности катода реагирующих частиц Н3О+;
2) разряд Н3О+ с образованием Надс
![]()
3) удаление выделяющегося Надс с поверхности электрода может происходить тремя путями:
а) каталитическая рекомбинация
![]()
где К at– материал катода;
б) электрохимическая десорбция – удаление Н2 происходит на уже адсорбированных атомах
![]()
в) эмиссия включает две стадии:
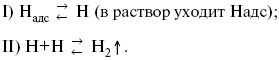
Для Pt замедлена стадия а), для других металлов (Hg, Pb) – стадия разряда, Н+ – самый подвижный.
Смотрите также
Кремний
Коробецкая Анастасия 10А
класс
КРЕМНИЙ
Научный
руководитель: Сукачева Т.А.
Ядро: возможна большая доля силикатов
Земная
кора: глины, граниты, базальты, полевые шпаты.
...
Методика определения массовой доли парафина
Методика
определения массовой доли парафина
по
ГОСТ 11851-85. (метод А)
Сущность метода А заключается в предварительном
удалении асфальтово-смолистых веществ из нефти, их э ...
