2. Уравнения электрохимической кинетики, пределы их применимостиКниги / Физическая химия / ЛЕКЦИЯ № 13. Электрохимическая кинетика / 2. Уравнения электрохимической кинетики, пределы их применимостиСтраница 1
1-й закон Фарадея
устанавливает прямую пропорциональность между количеством прошедшего через систему электричества и количеством прореагировавшего вещества.
Δm = kэJt = kэq , (1)
где Δm – количество прореагировавшего вещества;
k – коэффициент пропорциональности;
q – количество электричества, равное произведению силы тока I на время t .
Если q = Jt = 1, то Δm = kэ – количество вещества, прореагировавшего в результате протекания единицы количества электричества.
kэ – электрохимический эквивалент.
2-й закон Фарадея
устанавливает связь между количеством прореагировавшего вещества при пропускании данного количества электричества и его природой.
По этому закону, при постоянном количестве прошедшего электричества массы прореагировавших веществ относятся между собой, как их химические эквиваленты А :
![]()
Если количество электричества равно F , числу Фарадея, то Δm 1 = Fkэ 1 = A 1, Fkэ при q = 1F , то
![]()
Уравнение (3) позволяет объединить оба закона Фарадея в виде одного общего закона, по которому количество электричества (1F = 96500k) всегда изменяет электрохимически массу любого вещества, независимо от его природы.
Законы Фарадея
– основные законы электролиза, согласно которых, количество вещества, выделившегося при электролизе, прямо пропорционально его химическому эквиваленту и количеству прошедшего электричества.
Уравнение Нернста
Е 0 – равновесный стандартный потенциал.
![]()
где С0 – стандартная концентрация раствора;
С – любая концентрация в нестандартных условиях, С = С0 x Е = Е 0 , т. е. в стандартных условиях С = C0 = 1 моль.
Для окислительных веществ
![]()
1-й закон Фика:
![]()
где dc/dx – градиент концентрации;
s – площадь, через которую происходит диффузия.
Δ – коэффициент диффузии cм2 x c-1, показывает число частиц, продиффундировавших за 1 с через поперечное сечение раствора площадью 1 см2, dt – время диффузии, dm – число продиффундировавших частиц.
![]()
где Тк – коэффициент внутреннего трения;
D – коэффициент диффузии.
Первый закон Фика относится к процессу стационарной диффузии, сходен с закономерностями переноса тепла из электричества.
![]()
Если диффузионный поток не изменяется с течением времени, это называется стационарной диффузией
.
Диффузия
– самопроизвольно протекающий в системе процесс выравнивания концентрации молекул, ионов, частиц под влиянием теплового хаотического движения.
Основное уравнение электрохимической кинетики
ik = ia = i0,
где i 0 – ток обмена,
![]()
(окислительно-восстановительные реакции).
При катодной поляризации на электроде через систему протекает ik преимущественно, если поляризация не слишком велика, то суммарная скорость процесса равна:
i = ik – ia,
для реакции (1) катодные и анодные токи будут равны:
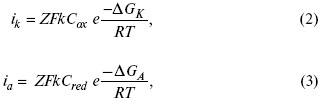
где Z – количество электронов, участвующих в реакции;
F – число Фарадея;
к – const скорости;
Сox, Cred – концентрация окислительной и восстановленной форм реагентов;
ΔGK – энергия активации катодного процесса;
ΔGA – энергия активации анодного процесса.
Энергия активации зависит от величины накладываемого потенциала, в то же самое время эта энергия распределяется между прямой и обратной реакцией в соответствии с коэффициентом переноса – а, т. е.
υ = υпр – υоб.
Коэффициент переноса α – доля энергии электрического поля в ДЭС, которая приходится на прямую и обратную реакции.
Смотрите также
Устойчивость дисперсных систем, седиментация и диффузия
...
Моделирование стационарного и нестационарного истечения адиабатно-вскипающей жидкости из коротких каналов
В работе [1] для анализа процесса нестационарного и
стационарного истечения вскипающей жидкости в термодинамически неравновесном
приближении использован нетрадиционный подход, в основу котор ...
