Замещенные одноосновные ароматические кислотыМатериалы / Синтез нитробензойной кислоты / Замещенные одноосновные ароматические кислотыСтраница 1
Нитробензойные кислоты
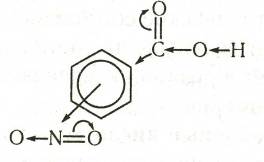
При нитровании бензойной кислоты получается 78%-мета-, 20% орто- и 2% пара-нитробензойных кислот. Два последних изомера без примесей других изомеров получают окислением орто- и пара- нитротолуолов.
Нитробензойные кислоты обладают более сильными кислотными свойствами, чем бензойная кислота (К = 6,6·10-5): о-изомер — в 100 раз, м-изомер — в 4,7 раза и п-изомер — в 5,6 раза. Аналогичная закономерность наблюдается и в случае галогенозамещенных кислот.
Константы ионизации замещенных бензойных кислот
|
Заместитель |
Положение | ||
|
орто- |
мета- |
пара- | |
|
CH3 |
1.2·10-4 |
5.3·10-5 |
4.2·10-5 |
|
OH |
1.1·10-3 |
8.3·10-5 |
3.3·10-5 |
|
OCH3 |
8.0·10-5 |
8.2·10-5 |
3.4·10-5 |
|
Br |
1.4·10-3 |
1.5·10-4 |
1.0·10-4 |
|
Cl |
1.2·10-3 |
1.5·10-4 |
1.0·10-4 |
|
NO2 |
6.7·10-3 |
3.1·10-4 |
3.7·10-4 |
Увеличение силы кислот с электроноакцепторными заместителями в п- и м-положении объясняется увеличением подвижности кислотного протона благодаря ослаблению связи О—Н (уменьшение электронной плотности)
Уравнение Гаммета было впервые использовано при изучении диссоциации м- и п-замещенных бензойных кислот. Для этой реакционной серии значение р было приняторавным 1 и, следовательно, уравнение Гаммета имело вид lgК/К0= ρ
σгде К — константа скорости или константа равновесия для замещенного соединения; К0 — аналогичная константа для незамещенного соединения; σ
— константа, характеризующая полярное влияние заместителя; ρ
— константа, определяющая степень чувствительности реакционного центра к полярным эффектам. Константа σзависит только от природы заместителя, а константа ρ
— от характера реакции.
Соединения с различными заместителями, но с одним и тем же реакционным центром образуют реакционную серию.
σ
-Константы некоторых заместителей приведены в таблице:
|
Заместитель |
σ |
Заместитель |
σ | ||
|
Мета- |
Пара- |
Мета- |
Пара- | ||
|
-H |
0 |
0 |
-I |
0.352 |
0.18 |
|
-CH3 |
-0.069 |
-0.17 |
-OH |
0.127 |
-0.37 |
|
-C2H5 |
-0.07 |
-0.151 |
-O |
-0.708 |
-0.519 |
|
-C(CH3)3 |
-0.1 |
-0.197 |
-OCH3 |
0.115 |
-0.268 |
|
-CF3 |
0.43 |
0.54 |
-NH2 |
-0.16 |
-0.66 |
|
-COOH |
0.355 |
0.265 |
-NHCOCH3 |
0.21 |
0 |
|
-COO- |
-0.1 |
0 |
-N(CH3)2 |
-0.211 |
-0.83 |
|
-COOC2H5 |
0.37 |
0.45 |
-N(CH3)3 |
0.88 |
0.82 |
|
-C0CH3 |
0.376 |
0.502 |
-NO2 |
0.71 |
0.778 |
|
-F |
0.337 |
0.062 |
-SO2 |
0.05 |
0.09 |
|
-CI |
0.373 |
0.227 |
-SO2NH2 |
0.46 |
0.57 |
|
-Br |
0.391 |
0.232 | |||
Смотрите также
Исследование диэлектрической релаксации в полимерных полувзаимопроникающих сетках
Поиск полимерных материалов с
модифицированным комплексом физических свойств ведет к использованию различного
рода композиционных систем, в которых важным фактором регулирования свойств
явл ...
Абсорбция аммиака
Абсорбция
— поглощение веществ из газа (обычно из газовой смеси) или жидкости жидкостями
или—реже—твердыми телами. Жидкость или твердое тело, поглощающие газ или
растворенное вещество, назы ...
Электрохимическая коррозия.
Электрохимическая коррозия является наиболее
распространенным типом коррозии металлов. По электрохимическому механизму
коррозируют металлы в контакте с растворами ...
