Водородные связи и свойства органических
соединенийМатериалы / ИК-спектральное проявление водородных связей / Водородные связи и свойства органических
соединенийСтраница 2
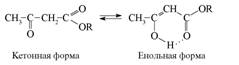
Рассмотрим несколько наиболее характерных примеров влияния водородных связей на свойства органических соединений. Прежде всего это так называемые прототропные процессы – превращения, связанные с переносом протона. Известно, что енольные структуры (гидроксильная группа находится при углероде с кратной связью =С–ОН) являются неустойчивыми и в органической химии часто такие формулы берут в квадратные скобки как указание на их нереальность, гипотетичность. В то же время b -дикетоны и другие 1,3-дикарбонильные соединения способны существовать в двух формах: кетонной и енольной. Для ацетоуксусного эфира эти превращения могут быть представлены схемой.
Образование энергетически менее выгодной енольной формы объясняется как формированием системы сопряженных связей С=С–С=О, что всегда является стабилизирующим фактором, так и тем обстоятельством, что между енольным гидрокси-лом и карбонильным кислородом образуется внутримолекулярная водородная связь, понижающая свободную энергию енольной формы как путем “закрепления” атома водорода у более электроотрицательного элемента, так и в результате удлинения цепи сопряжения (Н-связь включена в круговую цепь сопряжения). С учетом водородных связей не только объясняют реальность енольной структуры, но и количество этой формы в таутомерной системе. На состояние кето-енольного равновесия большое влияние оказывает природа растворителя. Максимальное количество енольной формы отмечается в нейтральных неполярных растворителях (углеводороды). В водных растворах количество енольной формы незначительно, так как вода конкурентно образует с карбонильным кислородом межмолекулярные водородные связи, разрушая стабилизирующие енольную форму внутримолекулярные водородные связи.
Карбоновые кислоты, как и спирты, могут участвовать в образовании Н-связей как в роли Н-доноров, так и Н-акцепторов. В первом случае кислотность снижается, во втором возрастает. Это ярко проявляется при ионизации двухосновных кислот: первая константа диссоциации (K 1) аномально велика, а вторая (K2) аномально мала. Для объяснения наблюдаемых экспериментальных результатов кроме электронных эффектов большая роль придается вкладу Н-связей. В исходной структуре Н-связь сильно активирует карбоксильную группу, выступающую в роли Н-акцептора. В образовавшемся на первой стадии диссоциации моноанионе образуется прочная внутримолекулярная Н-связь, резко снижающая кислотность второго карбоксила.
Межмолекулярные связи, возникающие между молекулами карбоновых кислот, настолько прочны, что даже в газообразном состоянии димерные структуры частично сохраняются.
Кстати, образование димера карбоновой кислоты помогает дать ответ на давний вопрос, что в большей степени определяет прочность водородной связи – кислотность группы Х–Н или основность фрагмента В.
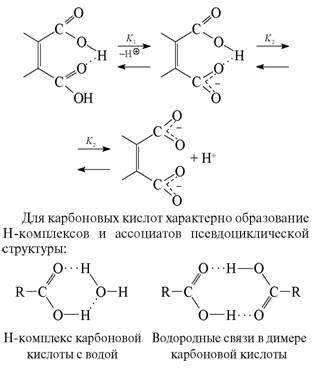
Уксусная кислота (pKa = 4,7) по кислотности на несколько порядков уступая трихлоруксусной (pKa = 0,6), тем не менее образует более прочный димер. Основность протоноакцептора имеет приоритет перед кислотностью протонодонора.
Смотрите также
Плутоний (Plutonium), Pu
Изотоп плутония 238Pu впервые искусственно получен 23.02.1941 года группой американских ученых во главе с Г. Сиборгом путем облучения ядер урана дейтронами. Примечательно, что только после искусственн ...
Применение радиоактивных изотопов в технике
...
Вольфрам (Wolframium), W
Температура нити электрической лампочки превышает 2500°С. Большинство металлов при такой температуре плавится, некоторые же кипят и быстро испаряются. В данном случае выручает вольфрам - самый туг ...
