Водородные связи и свойства органических
соединенийМатериалы / ИК-спектральное проявление водородных связей / Водородные связи и свойства органических
соединенийСтраница 1
Водородная связь возникает при взаимодействии кислотных Х-Н групп и основных В-групп, принадлежащих одной или разным молекулам. При объединении одинаковых молекул образуются ассоциаты, объединение разных молекул принято называть молекулярными комплексами. Такие взаимодействия составляют самый обширный класс водородных связей, называемых межмолекулярными водородными связями. Межмолекулярные взаимодействия не ограничиваются образованием бинарных комплексов, а могут приводить к структурам со множественными связями. Межмолекулярные водородные связи могут приводить к образованию цепей, колец или пространственных сеток. Аналогичные образования сохраняются и в кристаллах.
Если Н-связывание наступает в результате взаимодействия кислотного и основного фрагментов внутри одной молекулы, то образующиеся связи называют внутримолекулярными. Соединения с такими связями другую большую группу соединений с водородной связью. Образование внутримолекулярных водородных связей возможно, если структура молекулы допускает пространственное сближение фрагментов Х-Н и В до длины водородной связи. Возможность образования внутримолекулярной водородной связи не является препятствием для образования и межмолекулярных водородных связей.
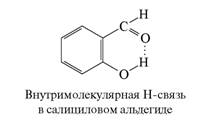
Экспериментально довольно легко отличить внутримолекулярную водородную связь от межмолекулярной. Если спектрально фиксируется образование Н-связей, а признаков ассоциации нет, это верное указание на внутримолекулярный характер водородной связи. Кроме того, межмолекулярная Н-связь исчезает при низкой концентрации вещества в нейтральном растворителе, тогда как внутримолекулярная Н-связь в этих условиях сохраняется
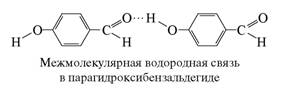
Экспериментально довольно легко отличить внутримолекулярную водородную связь от межмолекулярной. Если спектрально фиксируется образование Н-связей, а признаков ассоциации нет, это верное указание на внутримолекулярный характер водородной связи. Кроме того, межмолекулярная Н-связь (и ее спектральное проявление) исчезает при низкой концентрации вещества в нейтральном растворителе, тогда как внутримолекулярная Н-связь в этих условиях сохраняется.
Водородные связи влияют на перераспределение электронной плотности в молекулах, что не может не отразиться на свойствах веществ. В случае слабых водородных связей изменение электронной плотности протекает в основном в пределах фрагмента Х–Н…
В. С увеличением энергии водородной связи перераспределение электронной плотности затрагивает все атомы молекул, входящих в молекулярный комплекс, что в конечном итоге приводит к глубоким изменениям физических и химических свойств веществ. На свойства органических соединений оказывают значительное влияние как внутри-, так и межмолекулярные водородные связи. Влияние последних, особенно на физические свойства, является более существенным, так как межмолекулярные взаимодействия приводят к увеличению молекулярной массы со всеми вытекающими последствиями.
Теперь попытаемся ориентировочно оценить, насколько широко представлены водородные связи в органической химии. Все органические соединения за самым редким исключением содержат водород, то есть являются кислотами Бренстеда, а наиболее часто входящие в их состав элементы-органогены (O, N, S, галогены) содержат неподеленные пары электронов и могут выступать в качестве основных центров. Учитывая отмеченное, можно сказать, что большинство органических соединений потенциально способно к образованию водородных связей. По структурной формуле (природа взаимодействующих групп и их взаимное расположение) можно![]() предсказать силу водородных связей и их характер (внутри- или межмолекулярные). При оценке взаимного влияния атомов в молекулах обязательно учитываются возможность образования водородных связей и их последующее влияние на скорость, механизм и направление реакций. Оценить влияние среды (растворителя) на ход химического процесса часто становится возможным лишь с учетом образования водородных связей. Таким образом, подготовка грамотного химика невозможна без овладения всем комплексом вопросов, связанных с водородной связью.
предсказать силу водородных связей и их характер (внутри- или межмолекулярные). При оценке взаимного влияния атомов в молекулах обязательно учитываются возможность образования водородных связей и их последующее влияние на скорость, механизм и направление реакций. Оценить влияние среды (растворителя) на ход химического процесса часто становится возможным лишь с учетом образования водородных связей. Таким образом, подготовка грамотного химика невозможна без овладения всем комплексом вопросов, связанных с водородной связью.
Смотрите также
Таллий (Thallium), Tl
Знаменитый Крукс, был большим специалистом по спектроскопии. Прекрасно понимая, что спектроскоп - мощный инструмент отыскания новых элементов, Крукс исследовал с его помощью огромное количество различ ...
Моделирование стационарного и нестационарного истечения адиабатно-вскипающей жидкости из коротких
...
Магний
Магний – один из самых распространенных
в земной коре элементов, он занимает VI место после кислорода, кремния, алюминия, железа и кальция. В литосфере
(по А.П.Виноградову) содержание магния ...
