Титриметрический анализ, основные понятия и инструменты титриметрииСтатьи / Титриметрический анализ, основные понятия и инструменты титриметрииСтраница 4
На второй стадии остаток С оттитровывают основным титрантом В, как бы снова (обратно) возвращаясь к желаемому титранту (варианту титрования), что и отражено в названии метода. Например, достоинством перманганатометрии является возможность титрования без индикатора растворов веществ восстановителей стандартным раствором КМnО4, являющимся сильным окислителем в кислой среде (Е = 1,51В). В МЭ титруемый бесцветный раствор меняет свою окраску на розовую. Однако КМnО4 не реагирует с окислителями, поэтому в этом случае применяют обратное титрование. Например, перманганатометрическое определение содержания K2Cr2O7 можно показать схемой
KMnO4 1) FeSO4 2) KMnO4
(окислитель) (восстановитель) (окислитель)
избыток
без инд-ра => нельзя => без инд-ра + без инд-ра
от зел. до серого
K2Cr2O7 от оранж. до зелёного FeSO4
(окислитель) K2Cr2O7 (восстановитель)
(окислитель) остаток
Расчетную формулу для m(К2Cr2О7) получают из соотношений количеств веществ для стадий 1 и 2:
n1 (FeSO4) =n(1/6 K2Cr2O7)
![]()
n2 (FeSO4) ост n(1/5 KMnO4)
![]() откуда
откуда
![]()
или в общем виде
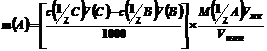 , г
, г
Заместительное (косвенное) титрование применяют, когда А и В не взаимодействуют или взаимодействуют не стехиометрически, или нельзя подобрать индикатор. Тогда все количество вещества А переводят (замещают) химической реакцией с заведомым избытком реагента Д в эквивалентное А количество вещества С, стехиометрически взаимодействующие с титрантом В, которым и оттитровывают С. Содержание А в растворе находят из соотношения
![]() Þ
Þ
![]() , которое приводит к формулам прямого титрования.
, которое приводит к формулам прямого титрования.
Заместительное титрование применяют, например, при иодометрическом определении окислителей. Иодометрия один из самых чувствительных титриметрических методов. Исключительная чувствительность объясняется применяемым индикатором - крахмалом, который синеет в присутствии ничтожных количеств молекулярного иода (I2) в ТЭ иодометрического титрования. Отчетливое окрашивание титруемого раствора в интенсивный синий цвет позволяет очень точно определять ТЭ даже при следовых количествах определяемых веществ. Однако прямое титрование окислителей (K2Cr2O7, KMnO4, CuSO4 и др.) стандартным раствором KI (восстановителя) осуществить невозможно, так как нельзя применить крахмал как индикатор, поскольку первая же капля KI приведет к образованию I2, раствор посинеет и дальнейшее добавление KI способствует только монотонному усилению этой окраски без резкого ее изменения в ТЭ. Поэтому, чтобы для определения окислителя применить иодометрическое титрование, его проводят в две стадии. На первой стадии к аликвоте раствора окислителя добавляют заведомый избыток нетитрованного раствора KI для замещения всего количества вещества окислителя эквивалентным количеством I2. Затем, на второй стадии, оттитровывают образовавшийся I2 в присутствии крахмала стандартным раствором тиосульфата натрия Na2S2O3. Например, такое определение содержания CuSO4 в растворе можно изобразить схемой
Смотрите также
Производство бета-каротина
...
Абсорбция двуокиси серы
ЗАДАНИЕ
НА ПРЕКТИРОВАНИЕ
Рассчитать
абсорбционную установку для улавливания двуокиси серы из смеси ее с воздухом и
водой при следующих условиях: производительность по газу при нормал ...
Металлсодержащие полимерные материалы
Металлсодержащие полимерные материалы являются предметом интенсивных исследований
в связи с перспективами их использования в различных областях техники и технологии.
Для синтеза металлполимерных ком ...
