Термодинамика поверхностного слояСтатьи / Термодинамика поверхностного слояСтраница 3
![]() ,
,
где r - плотность исследуемой жидкости;
n – число капель исследуемой жидкости;
sст, rст, nст – значения s, r и n для стандартной жидкости.
3. Метод отрыва кольца (рис. 2.1.2.1, в).
Измеряют силу F, которой противодействует поверхностное натяжение жидкости, смачивающей периметр поверхности кольца.
![]() ,
,
где k – поправочный коэффициент, учитывает, что поднимающийся при отрыве кольца столб жидкости не имеет формы правильного полого цилиндра.
Метод капиллярного поднятия (рис. 2.1.2.1, г).
В капилляре за счет смачивания образуется вогнутый мениск с радиусом кривизны r, поверхностное натяжение sжг вызывает капиллярное давление Dр. Оно уравновешивается весом Рн столба жидкости высотой Н:
![]() , (4)
, (4)
где q - краевой угол смачивания.
Капиллярное давление уравновешивается весом столба РН жидкости высотой Н, т.е. Dр = РН. С учетом (4) и веса столба жидкости можно записать:
![]() , (5)
, (5)
где r, r0 – плотность жидкости и газа (воздуха).
В связи с тем, что r >> r0, плотностью газа можно пренебречь, тогда высота подъема жидкости в капилляре определяется по формуле
![]() .
.
|
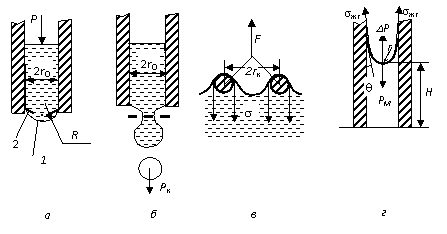
При полном смачивании, когда q = 0 и cosq = 1, имеем
![]() .
.
![]() - уравнение Жюрена,
- уравнение Жюрена,
где Dr – разность плотностей жидкости и газовой фазы;
g – ускорение свободного падения;
а – капиллярная постоянная.
Поверхностное натяжение индивидуальных веществ (жидкостей) монотонно убывает с возрастанием температуры.
![]() т=
т= ![]() 0 - a
0 - a![]() T,
T,
где ![]() т- поверхностное натяжение при данной температуре;
т- поверхностное натяжение при данной температуре;
![]() 0 - поверхностное натяжение при стандартной температуре;
0 - поверхностное натяжение при стандартной температуре;
DТ - разность температур;
а - температурный коэффициент; ![]() .
.
![]() Если вещество поверхностно активно, то с увеличением концентрации изотерма резко уменьшается (кривая 1 рис. 2.1.2.2).
Если вещество поверхностно активно, то с увеличением концентрации изотерма резко уменьшается (кривая 1 рис. 2.1.2.2).
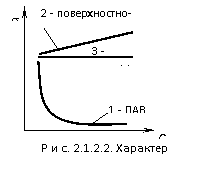
Это объясняется тем, что вначале вся поверхность раздела жидкой фазы свободна от поверхностно-активных веществ (ПАВ) и небольшое его количество, присутствующее в растворе, почти целиком уходит на поверхность. Затем следует криволинейный участок, отвечающий средней концентрации. В этих условиях значительная часть поверхности занята молекулами поверхностно-активных веществ (ПАВ), что снижает скорость повышения концентрации на границе раздела. Большим концентрациям на изотерме отвечает почти горизонтальный участок (кривая 3), показывающий, что поверхностное натяжение мало зависит от концентрации. При этих условиях на границе «жидкость – воздух» образуется сплошной монослой поверхностно-активного вещества (ПАВ), и увеличение его концентрации на границе невозможно в дальнейшем. При увеличении концентрации поверхностного инактивного вещества в растворе изотерма полого поднимается (кривая 2). Это объясняется тем, что поверхностные инактивные вещества благодаря высокому поверхностному натяжению и активности уходят в объем, а на границе раздела «жидкость – воздух» имеются лишь сравнительно небольшие концентрации вещества, попадающего туда за счет диффузии из объема раствора. При увеличении концентрации веществ, не влияющих на поверхностное натяжение, изотерма представляет собой прямую, параллельную оси концентрации. Следует отметить, что отнесение веществ к той или иной группе зависит от природы растворителя. Одно и тоже вещество для разных растворителей может быть и поверхностно-активным веществом (ПАВ), и не влиять на поверхностное натяжение.
Смотрите также
Методы определения хлорид-ионов
Защите окружающей среды от возрастающей антропогенной нагрузки в
настоящее время уделяется все большее внимание во всем мире. Развитие
промышленности, в том числе и химической, увеличение до ...
Моделирование парожидкостного равновесия в четырехкомпонентной смеси
...
Моделирование процессов переработки пластмасс
Курсовая работа
содержит расчет температурного поля литникового канала литьевой формы, теоретические
сведения о процессах происходящих в химической технологии связанных с
охлаждением и наг ...
