Теория структурообразованияСтатьи / Теория структурообразованияСтраница 1
Структурообразование по теории ДЛФО
Современная теория устойчивости носит имя учёных и известна в литературе как теория ДЛФО (DLVO).
Когда коллоидные частицы подходят очень близко друг к другу, их диффузные слои перекрываются и взаимодействуют. Это взаимодействие совершается в тонкой прослойке дисперсионной среды, разделяющей частицы. Устойчивость лиофобных золей определяется, главным образом, особыми свойствами этих тонких жидких слоёв.
Когда две коллоидные частицы, находящиеся в дисперсионной среде, сближаются, вначале они разделены толстым слоем жидкости, который постепенно утончается и в результате становится очень тонким.
После образования тонкого жидкого слоя утончение его может продолжаться, и это ещё больше сближает частицы. Утончение жидкого слоя заканчивается либо разрывом его при некоторой малой толщине, либо достижением некоторой равновесной толщины, которая далее не уменьшается. В первом случае частицы слипаются, а во втором – нет. Свойства этого тонкого жидкостного слоя определяют, произойдёт ли коагуляция, т. е. определяют устойчивость коллоидов.
Исследования показали, что утончение тонкого слоя при сближении частиц происходит путём вытекания из него жидкости. Когда жидкий слой становится достаточно тонким (толщина его меньше 100-200 нм), свойства жидкости в нём начинают сильно отличаться от свойств жидкости в окружающем объёме. В слое появляется дополнительное давление, которое В. Дерягин назвал “расклинивающим давлением”. По определению Дерягина, оно положительно, когда давление в слое понижено, это противодействует вытеканию из него жидкости, т.е. препятствует сближению коллоидных частиц. Отсюда происходит название “расклинивающее”, т.е. давление, которое раздвигает, “расклинивает” частицы. Расклинивающее давление может быть и отрицательным, т. е. повышать давление в слое, ускорять вытекание из него жидкости и способствовать сближению частиц.
Возникновение расклинивающего давления в тонких жидких слоях обусловлено такими факторами:
1) электростатическимвзаимодействием в слое, обусловленное взаимным перекрыванием двойных электрических слоев (ДЭС) – это силы отталкивания с энергией Uотт>0;
2) Ван-дер-Ваальсовыми силами притяжения
с энергией Uпр<0;
1) Адсорбционнымисилами, возникающими при перекрывании молекулярных адсорбционных слоев, где повышенная концентрация создает осмотический поток в сторону пленки, приводит к росту поверхностной энергии системы и, следовательно, к отталкиванию;
2) Структурным
, связанным с образованием граничных слоев растворителя с особой структурой. Он характерен для лиофильных систем и соответствует термодинамическим представлениям об адсорбционно-сольватном барьере. Эффект обычно положительны.
Результирующая энергия межчастичного взаимодействия U определяется как сумма двух составляющих:
![]()
Если |Uотт| > |Uпр|, то преобладают силы отталкивания, коагуляция не происходит, золь является агрегативно устойчивым. В противоположном случае преобладают силы притяжения между частицами, происходит коагуляция.
Рассмотрим количественную интерпретацию этих сил.
Электростатическое отталкивание между мицеллами возникает при перекрывании диффузных слоёв противоионов. Энергия этого взаимодействия:
![]() ,
,
где h – расстояние между частицами; ![]() - величина, обратная толщине диффузного слоя δ; A – величина, не зависящая от h и определяемая параметрами ДЭС.
- величина, обратная толщине диффузного слоя δ; A – величина, не зависящая от h и определяемая параметрами ДЭС.
Величины א и A могут быть рассчитаны на основе теории ДЭС.
Расчёты показывают, что энергия отталкивания уменьшается:
· при увеличении зарядов противоионов и их концентрации;
· при уменьшении по абсолютной величине φо и z-потенциала.
Из уравнения следует, что Uотт убывает с увеличением расстояния между частицами h по экспоненциальному закону.
Энергия притяжения связана, главным образом, с дисперсионным взаимодействием между молекулами. Она может быть рассчитана по уравнению
![]() ,
,
где AГ – константа Гамакера.
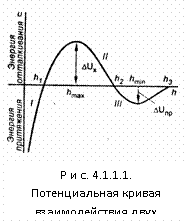 Из этого уравнения следует, что энергия притяжения изменяется с увеличением расстояния между частицами h обратно пропорционально квадрату расстояния. Таким образом, притяжение сравнительно медленно уменьшается с увеличением расстояния. Так, при увеличении h в 100 раз энергия притяжения уменьшается в 104 раз. В то же время энергия отталкивания уменьшается в 1043 раз.
Из этого уравнения следует, что энергия притяжения изменяется с увеличением расстояния между частицами h обратно пропорционально квадрату расстояния. Таким образом, притяжение сравнительно медленно уменьшается с увеличением расстояния. Так, при увеличении h в 100 раз энергия притяжения уменьшается в 104 раз. В то же время энергия отталкивания уменьшается в 1043 раз.
Смотрите также
Задание 4
1.Закончите уравнения реакций:
NaNO2+NaI+H2SO4→
NaNO2+KMnO4+H2SO4→
2. К 25г 8% раствора AlCl3 прилили 25г 8% раствора NaOH. Образовавшийся осадок отфильтровали и
прокалили. Опред ...
Электрохимическая коррозия.
Электрохимическая коррозия является наиболее
распространенным типом коррозии металлов. По электрохимическому механизму
коррозируют металлы в контакте с растворами ...
Состояния и уровни многоэлектронных атомов. Орбитали и термы. Векторная модель
...
