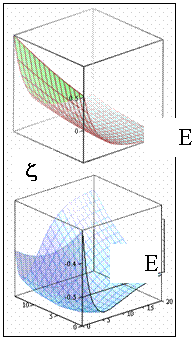
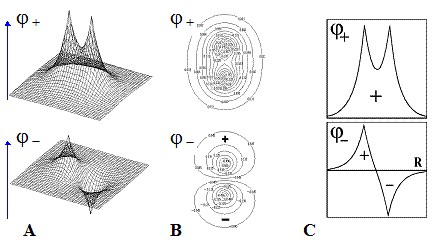
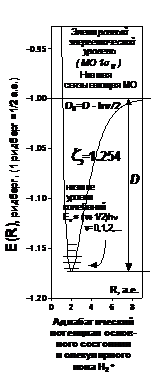График функции 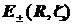 представляет собой поверхность. Рассматривая переход системы в минимум энергии вдоль одного лишь межъядерного расстояния, не следует забывать о сопутствующем изменении и второй переменной - показателя экспоненты базисной АО. Мысленное сближение частиц протекает в условном энергетическом минимуме адиабатического потенциала и завершается достижением точки абсолютного минимума. Условный минимум на поверхности энергии представляет собою пространственную кривую, а его проекция на координатной плоскости это плоская кривая, которую называют координатой реакции исследуемого процесса. В этом процессе образование молекулярной системы формально является лишь промежуточной стадией.
представляет собой поверхность. Рассматривая переход системы в минимум энергии вдоль одного лишь межъядерного расстояния, не следует забывать о сопутствующем изменении и второй переменной - показателя экспоненты базисной АО. Мысленное сближение частиц протекает в условном энергетическом минимуме адиабатического потенциала и завершается достижением точки абсолютного минимума. Условный минимум на поверхности энергии представляет собою пространственную кривую, а его проекция на координатной плоскости это плоская кривая, которую называют координатой реакции исследуемого процесса. В этом процессе образование молекулярной системы формально является лишь промежуточной стадией.
Применяя графические процессоры для современных персональных компьютеров (MATHCAD PLUS/PENTIUM 2,3,4), можно проиллюстрировать все вычисления. Наглядные пространственные графики на рис. изображают адиабатические потенциалы основного и первого разрыхляющего одноэлектронных уровней E± (z,R).
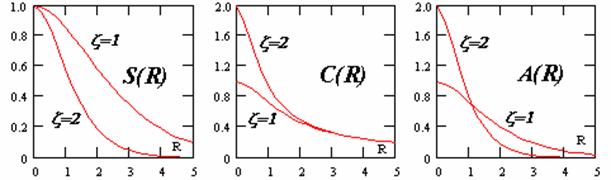
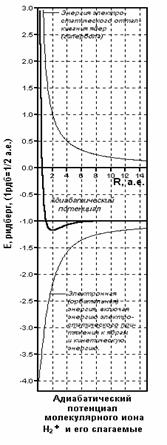
| Рис. 1. Зависимости от межъядерного расстояния одноэлектронных молекулярных интегралов: перекрывания
S
, кулоновского
C
, обменного
A
. | |
|
|
| | | | | | | | | | | | | |
| | |
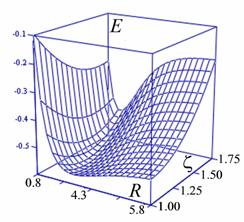
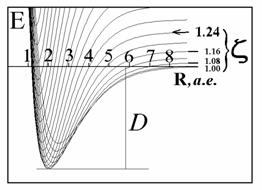
| | | | Рис.4а. Фрагмент адиабатического потенциала
E
(
R
,
z
) молекулярного иона
H
2
+
в области минимума. | |
|
|
| | | Рис.3. Оптимизиро-ванная энергетичес-кая кривая низшего связывающего уров-ня МО и низшие уровни колебаний у молекулярного иона водорода
H
2
+ | |
| | Рис.2. Слагаемые и ре-зультирующая кривая энергии основного элект-ронного состояния моле-кулярного иона водорода
H
2
+ | |
| | | | Рис.4. Варьирование экспоненты базисной АО: сечения адиабати-ческого потенциала для разных
z
и определение минимума энергии в основном состоянии иона
H
2
+
. | |
|
|
|
| | | Химическая связь есть результат баланса электростатических сил . Энергия связи представляет собой малую разность больших величин. | | | | Для анализа свойств двухцентровой химической связи удобно выделить результирующую энергетическую кривую в наглядном масштабе.
| | | | При оптимизации эффективного заряда ядра z
у базисных АО
координата абсолютного минимума адиабатического потенциала равна экспериментальной длине связи.
| |
Признаки св
![]() представляет собой поверхность. Рассматривая переход системы в минимум энергии вдоль одного лишь межъядерного расстояния, не следует забывать о сопутствующем изменении и второй переменной - показателя экспоненты базисной АО. Мысленное сближение частиц протекает в условном энергетическом минимуме адиабатического потенциала и завершается достижением точки абсолютного минимума. Условный минимум на поверхности энергии представляет собою пространственную кривую, а его проекция на координатной плоскости это плоская кривая, которую называют координатой реакции исследуемого процесса. В этом процессе образование молекулярной системы формально является лишь промежуточной стадией.
представляет собой поверхность. Рассматривая переход системы в минимум энергии вдоль одного лишь межъядерного расстояния, не следует забывать о сопутствующем изменении и второй переменной - показателя экспоненты базисной АО. Мысленное сближение частиц протекает в условном энергетическом минимуме адиабатического потенциала и завершается достижением точки абсолютного минимума. Условный минимум на поверхности энергии представляет собою пространственную кривую, а его проекция на координатной плоскости это плоская кривая, которую называют координатой реакции исследуемого процесса. В этом процессе образование молекулярной системы формально является лишь промежуточной стадией.