Кинетика углекислотной конверсии метанаСтатьи / Сравнительный анализ: методы получения синтез-газа / Кинетика углекислотной конверсии метанаСтраница 2
Большие значения tn получены для Ru/TiO2 (4,3.7,2), Ru/Al2O3 (1,5─4,3), Rh/VOx/SiO2 [4]. Для кристалликов Rh на носителе получен следующий ряд tn: ZrO2 > TiO2 ≥ Al2O3 > La2O3 = SiO2 > MgO. Этот ряд совпадает с рядом: TiO2 > Al2O3 > SiO2 и не совпадает с рядами: Al2O3 > La2O3 > CeO2 > MgO > TiO2 и MgO > TiO2 ≈ Al2O3 > SiO2 [13].
Было установлено, что число оборотов реакции не зависит от природы носителя: ZrO2 ≈ TiO2 ≈ Al2O3 ≈ SiO2. Такие противоречия могут быть объяснены влиянием обратной реакции, измерениями при разных объемных скоростях или неправильностью экстраполяций. Для нанесенных Ni-катализаторов получен следующий ряд tn:TiO2 > Al2O3 ≈ SiO2 ≈ MgO.
В подавляющем числе исследований установлено, что скорость углекислотной конверсии метана пропорциональна давлению СН4 в первой степени, в то время как величина ρCOn входит в кинетические уравнения, приведенные в разных работах, в числитель и знаменатель с показателем степени n от 0 до 2. Это указывает на то, что взаимодействие метана с катализатором является лимитирующей стадией.
Константы скорости взаимодействия СН4 и СО2 с единичным Ni-центром на Ni/TiO2 были измерены при 420 °С. С повышением температуры восстановления катализатора способность к диссоциации СН4 растет, а диссоциации СО2 не изменяется.
Положительный кинетический изотопный эффект (КИЭ) kCH4/kCD4, наблюдавшийся в процессе на Ni/γ-Al2O3, Ni/SiO2, Rh/SiO2 , Ni/La2O3 [13], также указывает на то, что стадия активации метана является лимитирующей, а диссоциация СО2 происходит легко. Для реакций на Ni/Al2O3 и Ni/La2O3 величина КИЭ растет с повышением температуры, причем в случае Ni/La2O3 КИЭ значительно выше, чем в процессе на Ni/Al2O3.
Исследование кинетики углекислотной конверсии метана на Ni/SiO2 при 700 0С и атмосферном давлении [13] позволило получить следующие данные: реакция первого порядка по ρСО2 и по ρН2, с ростом ρСН4 скорость реакции быстро увеличивается и достигает насыщения.
Для описания кинетики предложена схема
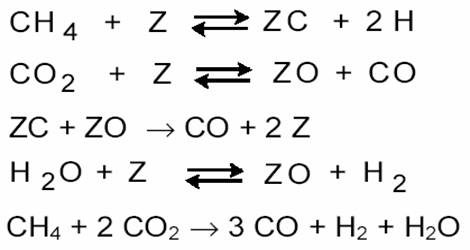 |
Лимитирующей стадией является поверхностное взаимодействие адсорбированных углерода и кислорода. По данным [13], кинетика углекислотной конверсии метана сильно зависит от обратной реакции ─ гидрирования CO:
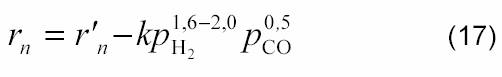 |
Энергия активации реакции по расходованию метана (ECH4) растет в ряду Ru/TiO2, Ru/Al2O3, Ru/C: 76,4; 107,4; 107,6 кДж/моль, соответственно. Такая же закономерность наблюдается для ECO2: 71,6; 75,4; 86,2 кДж/моль, что отвечает эффекту сильного взаимодействия металл-носитель.
EH2 = 17,1; 18,0; 20,6 кДж/моль, соответственно, была всегда больше ECO: 97,1; 125,2; 111,3 кДж/моль.
Смотрите также
Свидетельство Никола Фламеля
(Существует несколько версий истории Никола Фламеля, рассказанной им самим. Они
изложены у Уэйта в «Алхимиках сквозь века», у Кокрена в «Алхимии — заново открытой
и восстановленной в правах» и у С ...
Разработка методов синтеза SnF2
Основной путь получения SnF2 – взаимодействие SnO и фтористоводородной кислоты [5] с
последующим выпариванием и сушкой. Специфика технологии олова и его соединений
такова, что первичным продуктом пе ...
Получение феррита бария из отходов производства машиностроительных предприятий
Бария
гексаферрит, бария карбонат, отход термического производства, утилизация, бария
хлорид, гальваношлам.
В курсовой работе предложены методы получения феррита бария, который ...
