Кинетика углекислотной конверсии метанаСтатьи / Сравнительный анализ: методы получения синтез-газа / Кинетика углекислотной конверсии метанаСтраница 1
Первой работой по кинетике углекислотной конверсии метана (3) была работа, выполненная в лаборатории М.И. Темкина [11]. Основываясь на схеме
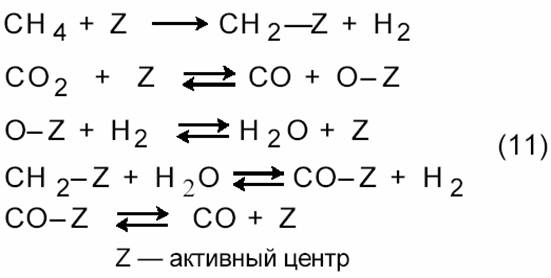 |
они показали, что в случае протекания процесса на никелевой фольге при 800─900 °С реакция описывается таким же кинетическим уравнением, что и паровая конверсия (1) на этом же катализаторе [27]:
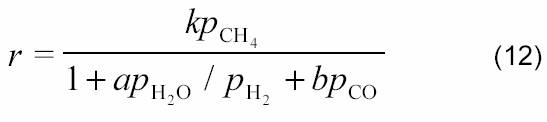
где k, a и b ─ константы; ρСН4, ρН2О, ρН2 и ρСО ─ парциальные давления метана, воды, водорода и СО, соответственно.
Если в смеси имеется водяной пар, то фактически протекает паровая конверсия СН4 с повторным быстрым образованием воды по реакции, обратной (6). В работе [11] подтверждается, что конверсия смесей СН4+СО2 и СН4+Н2О на катализаторе Ni/МgО соответствует одинаковому кинетическому уравнению.
В дальнейшем были найдены и другие уравнения. Например, для реакции, соединяющей углекислотную конверсию метана (3) и паровую конверсию СО (6):
СН4 + 2СО2 → Н2 + Н2О + 3СО (13)
на Ni/C, Ni/SiO2, Ni/TiO2 и Ni/MgO, а также на нанесенных Pt-катализаторах [12] было получено кинетическое уравнение:
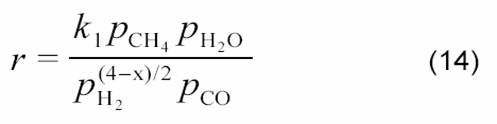 |
По мнению авторов [12], оно соответствует схеме:
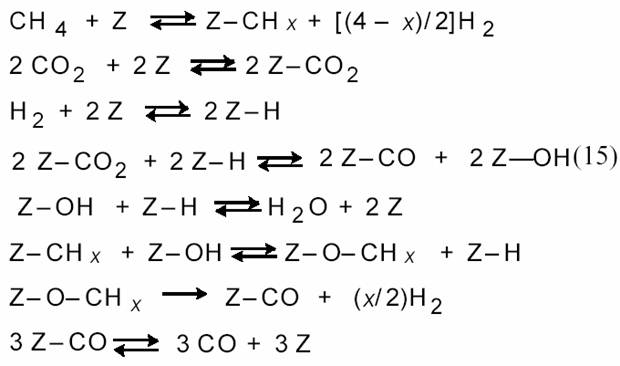
Для процесса на катализаторе Ni/Al2O3 было получено уравнение:
r = kp1/2 (16)
Существует сводка данных (взятых из более 60 статей) по исследованию кинетики углекислотной конверсии метана. Ниже дана краткая оценка этих данных.
Значения энергии активации Еа изменяются в интервале:
· по расходованию CH4 и CO2 соответственно от 30 до 350 кДж/моль и от 35 до 130 кДж/моль,
· по выходу CO и H2 соответственно от 38 до 218 кДж/моль и от 38 до 250 кДж/моль.
Наиболее выпадающие значения ЕСН4 относятся к реакции на Re/Al2O3 350 кДж/моль) и Pt (73 кДж/моль). Некоторые исследователи считают, что из числа достоверных данных следует также исключить значения энергии активации для реакции на Pb/MgO, т.к. EСО > EН2, причем ЕСО = 921 кДж/моль. Большинство остальных данных для Ni-катализаторов находятся вблизи значения 239 ± 20 кДж/моль, которое довольно близко к энергии активации диссоциации СН4 на Ni(110) и Ni(111): 233 ± 27 и 221 ± 20 кДж/моль, соответственно. Для катализа с участием благородных металлов Еа ближе к 314─377 кДж/моль.
На кажущиеся значения энергии активации углекислотной конверсии метана сильно влияет реакция (6), что отражается, по-видимому, в увеличении ЕСН4 с ростом объемной скорости. При этом снижается конверсия и влияние обратной реакции (гидрирование СО в СН4)становится менее значительным.
Каталитическая активность при 450 °С (экстраполяция), выраженная через число оборотов реакции tn, изменяется в интервале от 0,1 до 1,0.
Смотрите также
Современные направления развития композитов на основе полимеров
Современная техника предъявляет самые
разнообразные требования к полимерным материалам. Допустим, нужно повысить
прочность и жесткость полимера, снизить его стоимость, уменьшить плотность. С ...
Никель (Niccolum), Ni
Никель - химический элемент первой триады VIII группы периодической системы Менделеева, атомный номер 28, атомная масса 58,70; серебристо-белый металл, ковкий и пластичный. Природный Н. состоит из сме ...
Хроматографический анализ различных классов веществ
Выбор
конкретных условий проведения хроматографического анализа определяется тремя
основными факторами: составом анализируемой смеси; поставленной аналитической
задачей и имеющейся аппарату ...
