Примеры решения задач по курсу химииСтатьи / Примеры решения задач по курсу химииСтраница 3
По построенной диаграмме:
а) Определите тип диаграммы и её особенности;
б) Примените правило фаз Гиббса для всех полей, линий и характерных точек на этой диаграмме;
в) Постройте кривые охлаждения для сплавов, содержащих 0, 20, 15, 52, 80 и 100% висмута.
Сформулируйте правило фаз Гиббса, что называется фазой, компонентом, эвтектикой?
Решение:
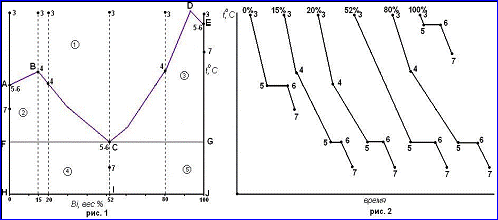
Данная диаграмма представляет собой диаграмму плавкости. В точках А и Е системы инвариантны. Правило фаз для них выглядит как: С = 1 – 2 + 1 = 0. При температурах выше t(A) и t(E) чистые компоненты находятся в расплаве (С = 1 – 1 + 1 = При температурах ниже t(A) и t(E) в твёрдом состоянии (С = 1 – 1 + 1 = 1).
Точка А характеризует температуру плавления Te, точка E характеризует температуру плавления Bi.
Линия ABCDE – линия ликвидуса.
Линия FCG – линия эвтектики, линия солидуса.
Линия AH – линия солидуса Te.
Линия EJ – линия солидуса Bi.
Линия ABC – расплав, насыщенный Te.
Линия CDE – расплав, насыщенный Bi.
Точка С – расплав, насыщенный Te и Bi.
Линии ликвидуса и солидуса делят диаграмму на несколько полей: 1- ненасыщенный расплав Bi и Te (С = 2 – 1 + 1 = 2); 2 – расплав компонентов Bi и Te и кристаллы Te (С = 2 – 2 + 1 = 1); 3 – расплав компонентов Bi и Te и кристаллы Bi (С = 2 – 2 + 1 = 1); 4 и 5 - кристаллы Bi и Te (С = 2 – 2 + 1 = 1).
Кривые охлаждения построены на рисунке 2. Все пробы, одинаковые по массе, но разные по концентрации, характеризуются точкой 3. Температурные остановки 5-6 на кривых охлаждения при 0 и 100% Bi указывают на то, что чистые компоненты кристаллизуются при постоянной температуре t(A) и t(E) (С = 1 – 2 + 1 = 0). Участки 3-5 и 6-7 соответствуют охлаждению чистых компонентов в жидком и твёрдом состояниях соответственно (С = 1 – 1 + 1 = 1). Кривые охлаждения 15, 20 и 80%: участок 3-4 отвечает охлаждению состава (С = 2 – 1 + 1 = 2). Точке 4 соответствует температура начала кристаллизации одного из компонентов (15, 20% - Te, 80% - Bi). За счёт выделяющейся теплоты кристаллизации в точке 4 наблюдается излом, но температура кристаллизации расплава не сохраняется постоянной, так как его состав непрерывно меняется, а число степеней свободы равно 1 (С = 2 – 2 + 1 = 1). На участке 4-5 в системе продолжается кристаллизация Te (15 и 20%) и Bi (80%) и каждой температуре соответствует определённый состав насыщенного расплава, который постепенно меняется до эвтектического. Расплав, соответствующий точке 5 становится насыщенным относительно обоих компонентов (точка C на диаграмме), начинается кристаллизация эвтектики, состоящей из кристаллов Te и Bi. Число степеней свободы уменьшается до нуля (С = 2 – 3 + 1 = 0) и температура остаётся постоянной до полного затвердевания смеси (участок 5-6). Продолжительность температурной остановки тем больше, чем ближе состав исходного расплава к составу эвтектики. Участок 6-7 соответствует охлаждению двухфазной системы в твёрдом состоянии (С = 2 – 2 + 1 = 1).
Правило фаз Гиббса – в равновесной системе, на которую из внешних факторов оказывают влияние только температура и давления, число степеней свободы равно числу компонентов минус число фаз плюс два.
Фаза – часть гетерогенной системы, ограниченная поверхностью раздела и характеризующаяся в отсутствие внешнего поля сил одинаковыми химическими, физическими и термодинамическими свойствами во всех своих точках.
Компонентом называют индивидуальное химическое вещество, которое является составной частью системы, может быть выделено из неё и существовать самостоятельно.
Эвтектика – есть смесь из нескольких (двух или более) компонентов, имеющая определённую характерную структуру, и дающая при температуре своего плавления расплав – раствор, насыщенный относительно всех компонентов, входящих в состав.
8. Возможно ли существование однокомпонентной системы, состоящей из четырёх фаз? Как доказать?
Решение:
Для однокомпонентной системы правило фаз Гиббса принимает вид:
C = 1 – Ф + 2 = 3 – Ф.
Если минимальное число степеней свободы равно нулю (система инвариантна), то Ф = 3. Значит, в равновесной однокомпонентной системе могут существовать максимально три фазы (т, ж, г).
Смотрите также
Поливинилпирролидон:
его применение и важнейшие характеристики
Поливинилпирролидон является виниловым полимером. В основном его получают
методом радикальной виниловой полимеризации из мономера винилпирролидона. ...
