Примеры решения задач по курсу химииСтатьи / Примеры решения задач по курсу химииСтраница 1
1. Закончите уравнения реакций:
P2O5+Ca(OH)2=
Sn+O2=
SnCl4+NaOH=
Sn(OH)4+NaOH=
[Mg(OH)]2CO3+HCl=
Ge+O2=
Al+NH3=
AlH3+O2=
SiH4→T
SiH4+O2=
Какие реакции можно использовать в технологии получения плёнок (каких), составить ионные уравнения реакций (где возможно).
Решение:
P2O5+3Ca(OH)2= Ca3(PO4) 2+ 3H2O
Sn+O2= SnO2
SnCl4+4NaOH= 4NaCl+Sn(OH)4
Sn(OH)4+4NaOH= Na4SnO4+4H2O
[Mg(OH)]2CO3+4HCl=2MgCl2+CO2+3H2O
![]()
![]()
Ge+O2= GeO2
2Al+2NH3=2AlH3+N2
2AlH3+O2=Al2O3+3H2O
SiH4→TSi+2H2
SiH4+2O2=SiO2+2H2O
2. При растворении в соляной кислоте 5,4 г сплава алюминия с цинком объём выделившегося водорода, приведённый к н. у. составил 3,8 л. Какой процентный состав сплава?
Решение:
Пусть х – масса алюминия в сплаве, тогда:
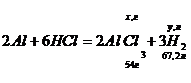
Находим V(H2), выделившийся при реакции Al с HCl:
x, г(Al) – y, л(H2)
54 г(Al) – 67,2 л(H2)
y = (67,2*x)/5,4 л.
![]()
Находим V(H2), выделившийся при реакции Zn с HCl:
z = ((5,4 г - x)*22,4)/65
Общий V(H2) при реакции сплава с HCl = 3,8 л, следовательно:
z + y = 3,8 (л), тогда находим массу Al:
(67,2 * x)/54+((5,4-x)*22,4)/64=3,8 (л).
22,4*(3x/54+(5,4-x)/64)=3,8
(22,4*46x+97,2)/1152=3,8
46x+97,2=3,8*1152/22,4
46x+97,2=195,4
46x=98,2
x = 2,14 (г) – масса алюминия.
Находим m (Zn):
5,4 – 2,14 = 3,26 (г)
W(Al) = (2,14/5,4)*100% = 39,6%
W(Zn) = (3,26/5,4)*100% = 60,4%
Ответ: состав сплава: 39,6% Al и 60,4% Zn.
3. Вычислить изменение энергии Гиббса для химической реакции:
4CO(Г)+2SO2(Г)=S2(T)+4CO2(Г),
при 25оС по стандартным значениям энтальпий образования и абсолютных энтропий. Реакция проводится между чистыми веществами:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
На основании вычисленной энергии Гиббса сделать вывод о возможности реакции? Измениться ли направление процесса при повышении температуры до 100о Какую роль при этом играют энтальпийный и энтропийный факторы?
Решение:
4СO(r)+2SO2(r)=S2(T)+4CO2(r)
Найдём изменения энтальпии:
![]()
Найдём изменение энтропии:
![]()
Зависимость энергии Гиббса реакции описывается уравнением
![]()
при стандартной температуре t=250C (T=298 K):
![]()
1) При t=1000C (T=373 K):
![]()
При стандартной температуре значение (![]() )
) ![]() свидетельствует о том что реакция смещается вправо, в сторону продуктов реакции, при
свидетельствует о том что реакция смещается вправо, в сторону продуктов реакции, при ![]() (
(![]() )
) ![]() но т. к.
но т. к. ![]() менее электроотрицательнее, то процесс смещения идет в право в меньшей степени. А если
менее электроотрицательнее, то процесс смещения идет в право в меньшей степени. А если ![]() было бы >0 то реакция изменила бы направление в обратную сторону.
было бы >0 то реакция изменила бы направление в обратную сторону.
Энтропийный и энтальпийный факторы определяют направление реакций, если энтропия не меняется ![]() , то фактором, определяющим направление реакции, служит энтальпия, если
, то фактором, определяющим направление реакции, служит энтальпия, если ![]() то и
то и![]() то это идет процесс с выделением тепла. Если же
то это идет процесс с выделением тепла. Если же ![]() , то система может перейти только в состоянии с большей энтропией
, то система может перейти только в состоянии с большей энтропией ![]() , из-за знака минус
, из-за знака минус ![]()
![]() изменение энергии Гиббса
изменение энергии Гиббса ![]() .
.
Смотрите также
Исследование физико-химических и прикладных свойств новых полимерных композиционных материалов на основе слоистых силикатов и полиэлектролитов
Актуальность темы.
Бентонитовые глины принадлежат к числу важнейших неметаллических полезных
ископаемых и широко используются в различных отраслях промышленности и
сельского хозяйства. Объе ...
Теоретическое изучение возможности изомеризации карбенов в четырех- или шестичленные гетероциклы
...
Методы обнаружения и измерения радиоактивного излучения радия и тория
РАДИОАКТИВНОЕ
ИЗЛУЧЕНИЕ, МЕТОДЫ ОБНАРУЖЕНИЯ И ИЗМЕРЕНИЯ, СРЕДСТВА ИЗМЕРЕНИЯ, ТОРИЙ-232,
РАДИЙ-226, ПИЩЕВЫЕ ПРОДУКТЫ.
Цель
курсовой работы: целью данной курсовой работы является ознакомле ...
