Примеры решения задач по курсу химииСтатьи / Примеры решения задач по курсу химииСтраница 2
4. Исходя из теплот реакций окисления As2O3 кислородом и озоном
As2O3+O2= As2O5 ![]()
3As2O3+2O3= 3As2O5 ![]()
Вычислить теплоту образования озона из молекулярного кислорода
3/2O2→O3.
Решение:
Первое уравнение умножим на 3:
3As2O3+3O2=3As2O5 ![]()
3As2O3+2O3=3As2O5 ![]()
Вычтем из первого уравнения второе:
3O2=2O3 или 3/2О2=О3.
![]()
- процесс самопроизвольно протекать не может.
5. Константа равновесия реакции FeO(T)+CO«Fe(T)+CO2 при некоторой температуре равна 0,5. Найти равновесные концентрации CO и CO2, если начальные концентрации этих веществ составляли: [CO]=0,05 моль/л, [CO2]=0,01 моль/л.
Решение:
FeO(T)+CO ![]() Fe(T)+CO2
Fe(T)+CO2
К=0,5.
Начальные концентрации [CO]=0,05моль/л; [CO2]=0,01моль/л.
По мере течения реакции концентрация исходных веществ уменьшается, а концентрация продуктов реакции увеличивается. Изменение концентрации идет в строгом соответствии со стехиометрическими соотношениями, которые берутся из уравнения реакции, примем изменение концентрации [СО] до равновесия равному Х моль/л тогда в момент равновесия его концентрация станет 0,05-Х, а у СО2 увеличится на Х, т.е. будет 0,01+Х. Коэффициенты в уравнении одинаковы n(CO)=n(CO2). Для момента равновесия ![]() концентрации взяты равновесны.
концентрации взяты равновесны.
![]()
0,025-0,5Х=0,01+Х или 1,5Х=0,015
т. е. Х=n=0,01моль/л отсюда в момент равновесия:
[CO2]1=0,01+0,01=0,02моль/л
[CO]1=0,05-0,01=0,04моль/л
Ответ: [CO2]=0,02моль/л; [CO]=0,04моль/л.
6. В состоянии равновесия системы CO2+H2=CO+H2O(Г) реакционная смесь имела объёмный состав: 22% CO2, 42% H2, 17% CO, 20% H2O. Вычислить Kp и Kc для этой реакции при 1900 К и давлении 98501 Па.
Решение:
Для вычисления константы равновесия Kp воспользуемся парциальными давлениями реагирующих веществ:
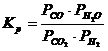
Определим парциальные давления реагирующих веществ:
![]()
![]()
![]()
![]()
Определяем Kp:
![]()
Между Kp и Kc существует следующая взаимосвязь:
![]()
где ![]() - разность между числом молей газообразных веществ продуктов реакции и исходных веществ:
- разность между числом молей газообразных веществ продуктов реакции и исходных веществ:
![]() =2-2=0, следовательно:
=2-2=0, следовательно: ![]() .
.
Ответ: Kp = Kc = 0,37.
7. Постройте диаграмму состояния систем висмут-теллур по следующим данным:
|
Bi, вес % |
100 |
93 |
80 |
60 |
52 |
30 |
15 |
0 |
|
Температура появления кристаллов, оС |
271 |
250 |
400 |
540 |
570 |
480 |
398 |
430 |
Смотрите также
Введение
Это была настоящая тайна. Я оказался не в состоянии противиться такому соблазну.
С одной стороны, алхимия — поиск легендарного Философского камня, таинственной субстанции,
позволяющей осуществить ...
Радий (Radium), Ra
Французские ученые Пьер и Мария Кюри обнаружили, что отходы, остающиеся после выделения урана из урановой руды (урановая смолка, добывавшаяся в городе Иоахимсталь, Чехия), более радиоактивны, чем чист ...
Моделирование стационарного и нестационарного истечения адиабатно-вскипающей жидкости из коротких
...
