Правила, механизм и кинетика коагуляцииСтатьи / Правила, механизм и кинетика коагуляцииСтраница 4
где n - концентрация частиц;
t - время.
Знак "-" стоит потому, что концентрация частиц со временем уменьшается, а скорость всегда положительна.
Степень коагуляции a:
![]() ,
,
где Z - общее число столкновений частиц в единицу времени; Zэф - число эффективных столкновений (т.е. столкновений, приводящих к коагуляции) в единицу времени.
Если a = 0, коагуляция не происходит, коллоидный раствор агрегативно устойчив.
Если a = 1, происходит быстрая коагуляция, т.е. каждое столкновение частиц приводит к их слипанию.
Если 0 < a < 1, наблюдается медленная коагуляция, т.е. только некоторые столкновения частиц приводят к их слипанию.
Чтобы частицы при столкновении слиплись, а не разлетелись как упругие шары, должен быть преодолен потенциальный барьер коагуляции ΔUк. Следовательно, коагуляция произойдет только в том случае, когда коллоидные частицы будут обладать кинетической энергией, достаточной дл преодоления этого барьера. Для увеличения степени коагуляции необходимо снижать потенциальный барьер. Это может быть достигнуто добавлением к золю электролита – коагулянта.
Зависимость скорости коагуляции от концентрации электролита представлена на рис. 3.1.2.5.
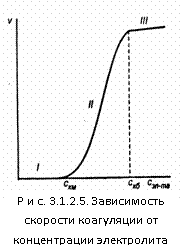
На графике видны три участка:
I. ![]() .
.
Следовательно, кинетическая энергия kТ << ΔUк, (k – постоянная Больцмана) – лиофобный золь агрегативно устойчив.
II. ![]() , т.е. потенциальный барьер коагуляции больше, но соизмерим с кинетической энергией коллоидных частиц, причем с увеличением концентрации электролита – коагулянта он уменьшается, а скорость коагуляции возрастает. Скм – порог медленной коагуляции, Скб – порог быстрой коагуляции. Этот участок кривой выражает зависимость:
, т.е. потенциальный барьер коагуляции больше, но соизмерим с кинетической энергией коллоидных частиц, причем с увеличением концентрации электролита – коагулянта он уменьшается, а скорость коагуляции возрастает. Скм – порог медленной коагуляции, Скб – порог быстрой коагуляции. Этот участок кривой выражает зависимость:
На этом участке происходит медленная коагуляция.
III. ![]()
Каждое столкновение приводит к слипанию частиц – идет быстрая коагуляция.
Теория быстрой коагуляции, разработанная М. Смолуховским в 1916 г., основана на следующих положениях.
1. Рассматриваемая система является монодисперсной, радиус частиц r.
2. ![]() , т.е. все столкновения являются эффективными.
, т.е. все столкновения являются эффективными.
3. Рассматриваются только столкновения первичных частиц.
4. Кинетика коагуляции подобна кинетике бимолекулярной реакции:
![]() ,
,
где k – константа скорости коагуляции.
Проинтегрируем это уравнение, разделив переменные:
![]()
![]() ,
,
где u0 – концентрация частиц золя в начальный момент времени;
ut – концентрация частиц золя в момент времени t.
Для характеристики быстрой коагуляции используется период коагуляции(период половинной коагуляции) q.
Период коагуляции (
q
) – это время, через которое концентрация коллоидных частиц уменьшается в два раза
.
При ![]()
![]()
Согласно теории быстрой коагуляции, константа коагуляции зависит от коэффициента диффузии и может быть вычислена по уравнению
![]()
Если подставить в это уравнение величину коэффициента диффузии, получим:
![]()
Таким образом, зная вязкость дисперсионной среды и температуру, можно вычислить константу скорости быстрой коагуляции. Теория Смолуховского неоднократно проверялась экспериментально и получила блестящее подтверждение, несмотря на сделанные автором допущения.
Медленная коагуляция связана с неполной эффективностью столкновений вследствие существования энергетического барьера. Простое введение величины степени коагуляции a в формулы теории Смолуховского не привело к согласию теории с опытом. Более совершенную теорию медленной коагуляции разработал Н.Фукс. Он ввел в кинетическое уравнение коагуляции множитель, учитывающий энергетический барьер коагуляции ΔU к:
![]() ,
,
где kКМ – константа скорости медленной коагуляции;
Смотрите также
Состав, структура и синтез ионообменных смол
Иониты, ионообменники, ионообменные сорбенты,
твёрдые, практически нерастворимые вещества или материалы, способные к ионному
обмену. Иониты могут поглощать из растворов электролитов (солей, ...
