Химическая кинетикаПериодическая система / Методика решения задач по теоретическим основам химической технологии / Химическая кинетикаСтраница 2
называется общим порядком реакции
. Для элементарной реакции общий порядок равен молекулярности, а порядок по веществам равны коэффициентам в уравнении реакции. Порядок реакции по i-
тому компоненту не равен его стехиометрическому коэффициенту в химическом уравнении сложной реакции.
1
. Реакции нулевого порядка. Скорость этих реакций не зависит от концентрации реагирующего вещества n=0. Из уравнений 1.3.1 и 1.3.3 получим следующее
w=k или ![]() . (1.3.4)
. (1.3.4)
Интегрируя выражение (1.3.4) получаем:
CA,t=CA,0 – k0t, k0t = CA,0 – CA,t (1.3.5)
Введем понятие время полупревращения t1/2
– это время, в течение которого превращается половина исходного вещества.
Для реакции нулевого порядка в уравнение 1.3.5 подставим ![]()
t1/2
=
![]()
2.
Реакции первого порядка. Для реакции первого порядка n=1 типа
А ® Р1+ Р2 + …, скорость прямо пропорциональна концентрации вещества А:
w=![]() ;
; ![]()
lnCA,t = lnCA,0 – kt
С=СА,t=CA,0 e-kt
t1/2= ![]()
3.
Реакции второго порядка. Для реакции второго порядка n=2 типа
А + В ® Р1+ Р2 + ., если СА,0=СВ,0 кинетическое уравнение имеет вид
w=![]() ;
; ![]()
![]()
t1/2![]()
![]()
Для реакции второго порядка типа А + В ® Р + … если СА,0 ¹ СВ,0 кинетическое уравнение имеет вид
w=![]()
Периоды полураспада вещества А и В, если СА,0 ¹ СВ,0, различны,
т.е. t1|2 (A)¹ t1|2 (B).
4.
Реакции третьего порядка. Кинетика реакции третьего порядка n=3 типа
2А + В ® Р1+ Р2 + … 3А ® Р1+ Р2 + …, А + В + С ® Р1+ Р2 + …
при равных начальных концентрациях описывается уравнением
w
=
![]()
t1|2=
![]()
Для реакции А + В + С ® Р + …,если СА,0 ¹ СВ,0¹СС,0 кинетическое уравнение примет вид
w=![]()
II.
Выражение (1.3.1) записано для фиксированной температуры. Для приближенной оценки изменения скорости широко используется эмпирическое правило Вант-Гоффа, в соответствии с которым скорость химической реакции становится в 2-4 раза больше при повышении температуры на каждые 10°C. В математической форме зависимость изменения скорости реакции от температуры выражается уравнением
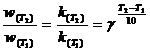 (1.3.4)
(1.3.4)
![]() — скорость реакции при повышенной температуре Т2,
— скорость реакции при повышенной температуре Т2,
![]() - скорость реакции при начальной температуре Т1; γ
- скорость реакции при начальной температуре Т1; γ
—температурный коэффициент скорости, показывающий, во сколько раз увеличится скорость реакции при повышении температуры на 10°С (2-4). Это позволяет предположить, что между скоростью реакции и температурой должна существовать экспоненциальная зависимость. Точное соотношение между скоростью реакции и температурой установил шведский химик Аррениус в 1899 г. Это соотношение, получившее название уравнение Аррениуса, имеет вид
Смотрите также
Резерфордий (Rutherfordium), Rf
Резерфордий - искусственно полученный радиоактивный химический элемент IV группы периодической системы Менделеева, атомный номер 104. Известны только радиоактивные изотопы: 260Rf и 259Rf (периоды полу ...
Ксенон (Xenonum), Xe
Ксенон - химический элемент VIII группы периодической системы Д. И. Менделеева, относится к инертным газам; ат. н. 54, ат. м. 131,30. На Земле К. присутствует главным образом в атмосфере. Атмосферный ...
