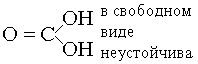Получение углерода
![]()
![]() Сухая перегонка
Сухая перегонка
древесины каменного угля
древесный уголь кокс
активированный уголь
Самый чистый углерод – сажа
CH4 ® C + 2H2
Химические свойства
- малоактивен, на холоде – только с F2 ® CF4
Восстановитель ¬ Слабо выражены ® Окислительные
1) O2 + C ® CO2 ниже 500°C ü
ý загорается
CO2 + C ® CO выше 900°Cþ
2) H2O + C ® CO + H2 выше 1200°C
2H2O + C ® CO2 + CO2 + H2 выше 1000°С
3) CuO + C ® Cu + CO при t
Cu+2 +2e® Cu0 – окислитель, восстанавливается
C0 -2e® C+2 – восстановитель, окисляется
4) HNO3 + 3C ® 3 CO2 + 4 NO + 2 H2O
с H2SO4 разбавленная
Cu+2 +2e® Cu0 – окислитель, восстанавливается
C0 -2e® C+2 – восстановитель, окисляется
![]() C
C
![]() 1) Ca + 2C ® Ca úúú карбид кальция
1) Ca + 2C ® Ca úúú карбид кальция
C
C + Si ® CSi карборунд
другой способ:
CaO + C ® CaC2 + CO
2) 2H2 + C ® C-4H+4
Рассмотрим с точки зрения ox-red:
4H0 -4e® 4H+ – восстановитель, окисляется
C0 +4e® C-4 – окислитель, восстанавливается
Углерод может быть и окислителем и восстановителем.
|
4+ |
2+ |
n- |
|
Оксид углерода (IV) CO2
Без цвета и запаха, растворим в воде; -76°C – сухой лед; Получение: в промышленности обжиг известняка CaCO3 ® CaO + CO2 в лаборатории – вытеснение сильной кислотой CaCO3 + 2HCl ® CaCl2+ + CO2 + H2O Окислительные свойства выражены слабо: только при высоких температурах, с металлами, сродство к кислороду, которых больше, чем у C (Mg, K) 2Mg + CO2 ® 2MgO + C Кислотный оксид при растворении в воде, образуется небольшое количество угольной кислоты
1. 2NaOH + CO2 ® ® Na2CO3 + H2O; Na2CO3 + H2O + CO2 ® ® 2NaHCO3 Этим способом могут быть получены соли угольной кислоты. Другой способ: 2. Обменная реакция BaCl2 + Na2CO3 ® ® BaCO3¯ + 2NaCl Соли: 1) карбонаты, растворимы в воде – только щелочных и NH+4 сильный гидролиз. При нагревании Ca(HCO3)2 ® CaCO3 + + CO2 + H2O CaCO3 ® CO2 + CaO Карбонаты щелочных металлов плавятся без разложения. Качественная реакция “вскипание” – сильная кислота CaCO3 + 2HCl ® CaCl2+ + CO2 + H2O CO2 вызывает помутнение известковой и баритовой воды Ca(OH)2 + + CO2 ® CaCO3 + H2O Растворение, ведущее к разрушению старых известковых гор. CaCO3 + H2O + CO2 ® ® Ca(HCO3)2 |
Оксид углерода (II) CO (угарный газ) Бесцветный газ, без запаха, ядовит, т.к. соединяется с гемоглобином крови. Плохо растворим в воде. Получение: горение при недостатке O2 2C + O2 ® 2CO 2CH4 + 3O2 ® 2CO + + 4H2O В лаборатории: действие концентрирован. H2SO4 HCOOH ® CO + H2O Щавелевая кислота H2C2O4 ® CO + CO2+ + H2O Восстановитель Fe2O3 + + 3CO ® 2Fe + 3CO2 O2 + 2CO ® 2CO2 Несолеобразующий, но при t = 200°C, 20 атм NaOH + CO ® O ® HC O – Na |
Органические соединения CH4 карбиды – получаются при непосредственном взаимодействии с металлами. 2 группы. I. Карбиды металлического характера. Переходные Me + C. Электронная проводимость, металлический блеск. II. Ионные карбиды более электроположительные, бесцветные, прозрачные, не проводят электрический ток. 1) Al4C3 + 12H2O ® ® 4Al(OH)3 + 3CH4 c Be2C – та же реакция 2) CaC2 + 2H2O ® ® Ca(OH)2 + C2H2 Na2C2; K2C2; SrC2; BaC2; Cu2C2 При гидролизе – ацетилен и ненасыщенные углеводороды из Mg2C2; Fe3C, лантанидов. |
Смотрите также
Введение
Комплексные
фториды многих редких металлов интересны как по своей структуре и свойствам,
так и в качестве материалов для развития многих направлений новой техники.
Примерами могут служить фротоцир ...
Химия белка
Биохимия - это
наука о химических и физико-химических процессах, которые протекают в живых
организмах и лежат в основе всех проявлений жизнедеятельности. Биохимия
возникла на стыке органиче ...
Исследование диэлектрической релаксации в полимерных полувзаимопроникающих сетках
Поиск полимерных материалов с
модифицированным комплексом физических свойств ведет к использованию различного
рода композиционных систем, в которых важным фактором регулирования свойств
явл ...