Аномалии водыМатериалы / Аномалии водыСтраница 3
И в физиологическом отношении тяжёлая вода воздействует на живое вещество иначе: в отличие от обычной воды, обладающей живительной силой, тяжёлая вода совершенно инертна. Семена растений, если их поливать тяжёлой водой, не прорастают; головастики, микробы, черви, рыбы в тяжёлой воде не могут существовать; если животных поить одной тяжёлой водой, они погибнут от жажды. Тяжёлая вода – это мёртвая вода.
Омагниченная вода. Имеется ещё один вид воды, отличающийся по физическим свойствам от обычной воды, - это омагниченная вода. Такую воду получают с помощью магнитов, вмонтированных в трубопровод, по которому течет вода. Омагниченная вода изменяет свои физико-химические свойства: скорость химических реакций в ней увеличивается, ускоряется кристаллизация растворённых веществ, увеличивается слипание твёрдых частиц примесей и выпадение их в осадок с образованием крупных хлопьев (коагуляция). Омагничивание успешно применяется на водопроводных станциях при большой мутности забираемой воды. Она позволяет также быстро осаждать загрязненные промышленные стоки.
§3. Физические свойства. Аномалии воды.
Вода — это не только реки, моря, океаны, ледники, облака, дождь, снег. Ее находят в пустынях, которые называются безводными. Вода содержится в горных породах. Даже в расплавленной магме она присутствует в значительных количествах и выделяется в виде пара при извержении вулканов. Ни один процесс на Земле — гео- или техногенный — не проходит без участия воды. Да и сама жизнь на планете оказалась возможна только благодаря замечательным свойствам воды.
Чистая вода — бесцветная жидкость, без вкуса и запаха, кипит при 100°С (при давлении 101,3 кПа), замерзает при О °С, ее максимальная плотность (при 4 °С) равна 1 г/см3
На первый взгляд, вода кажется очень простым соединением, состоящим из атомов водорода и кислорода. На самом деле это самое аномальное вещество в мире.
В ряду однотипных водородных соединений элементов главной подгруппы VI группы H2S — H2Se — Н2Те температуры плавления и кипения с увеличением относительной молекулярной массы возрастают .
В соответствии с этой закономерностью вода должна замерзать около -100, кипеть около -80 0С
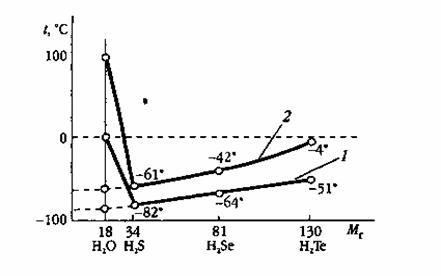
Зависимость температур плавления 1 и кипения 2 водородных соединений элементов главной подгруппы VI группы от молекулярной массы.
|
название |
теллуроводород |
селеноводород |
сероводород |
вода | |
|
формула |
Н2Те |
Н2Sе |
Н2S |
Н2О | |
|
t плавления |
- 510 С |
- 640 С |
- 820 С |
00 С | |
|
t кипения |
- 40 С |
- 420 С |
- 610 С |
1000 С | |
|
молекул. масса |
130 |
81 |
34 |
18 | |
Смотрите также
Серебро (Argentum), Ag
Серебро - химический элемент I группы периодической системы Менделеева, атомный номер 47, атомная масса 107,868; металл белого цвета, пластичный, хорошо полируется. В природе находится в виде смеси дв ...
Введение
Свою дипломную работу хочу
начать со слов ученого-земляка М.В. Ломоносова, которые являются эпиграфом
данной работы:
“Вольность и союз наук необходимо
требуют взаимного сообщения и беззавистного ...
Модификация вторичных полимеров для изготовления изделий различного функционального назначения
...
