Реакции первого порядкаПериодическая система / Лекции по коллоидной химии / Реакции первого порядка
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А ––> В. Реакции первого порядка характеризуются кинетическим уравнением вида (II.6). Подставим в него выражение (II.2):
![]() (II.6)
(II.6)
![]() (II.7)
(II.7)
После интегрирования выражения (II.7) получаем:
![]() (II.8)
(II.8)
Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со. Получаем:
![]() (II.9)
(II.9)
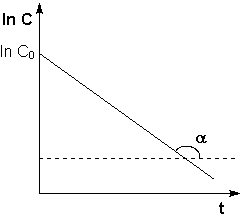
Рис. 2.3Зависимость логарифма концентрации от времени для реакций первого порядка
Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 2.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени.
![]() (II.10)
(II.10)
Из уравнения (II.9) легко получить выражение для константы скорости односторонней реакции первого порядка:
![]() (II.11)
(II.11)
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со:
![]() (II.12)
(II.12)
Отсюда
![]() (II.13)
(II.13)
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
Смотрите также
ЛЕКЦИЯ № 2. Химическая термодинамика
Химическая термодинамика – наука, изучающая условия устойчивости
систем и законы.
Термодинамика – наука о макросистемах.
Она позволяет apriori определить принципиальную невозможн ...
Классификации катализаторов
Существуют
различные типы классификации катализаторов, в основе которых лежит определенная
совокупность свойств или характеристик. Наиболее широко используется
классификация по типу веществ ...
Классификация дисперсных систем по агрегатному состоянию. Особенности каждой системы
...
