Приложения первого начала термодинамики к химическим
процессам. Закон
ГессаПериодическая система / Лекции по коллоидной химии / Приложения первого начала термодинамики к химическим
процессам. Закон
ГессаСтраница 1
Как известно, большинство химических реакций сопровождаются выделением (экзотермические реакции) либо поглощением (эндотермические реакции) теплоты. Первое начало термодинамики дает возможность рассчитать тепловой эффект химической реакции при различных условиях её проведения.
Тепловой эффект (теплота) химической реакции – количество теплоты, выделившейся либо поглотившейся в ходе реакции. Тепловой эффект относят, как правило, к числу молей прореагировавшего исходного вещества, стехиометрический коэффициент перед которым максимален.
Например, реакцию окисления водорода в химической термодинамике записывают в виде:
Н2 + 1/2 О2 ––> Н2О
и тепловой эффект рассчитывают на 1 моль водорода.
Тепловые эффекты, сопровождающие протекание химических реакций, являются предметом одного из разделов химической термодинамики – термохимии. Определим некоторые понятия термохимии.
Теплота образования вещества – тепловой эффект реакции образования 1 моля сложного вещества из простых. Теплоты образования простых веществ принимаются равными нулю.
Теплота сгорания вещества – тепловой эффект реакции окисления 1 моля вещества в избытке кислорода до высших устойчивых оксидов.
Теплота растворения – тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. Теплота растворения складывается из двух составляющих: теплоты разрушения кристаллической решетки (для твердого вещества) и теплоты сольватации:
![]()
Поскольку ΔНкр.реш всегда положительно (на разрушение кристаллической решетки необходимо затратить энергию), а ΔНсольв всегда отрицательно, знак ΔНраств определяется соотношением абсолютных величин ΔНкр.реш и ΔНсольв:
![]()
Основным законом термохимии является закон Гесса, являющийся частным случаем первого начала термодинамики:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Выше было показано, что изменение энтальпии ΔН (тепловой эффект изобарного процесса Qp) и изменение внутренней энергии ΔU (тепловой эффект изохорного процесса Qv) не зависят от пути, по которому система переходит из начального состояния в конечное.
Рассмотрим некоторый обобщенный химический процесс превращения исходных веществ А1, А2, А3 в продукты реакции В1, В2, В3, который может быть осуществлен различными путями в одну или несколько стадий:
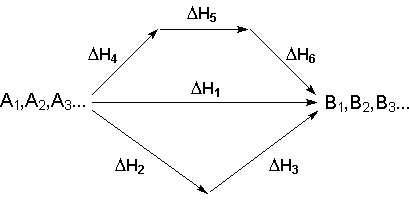
Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
![]() (I.17)
(I.17)
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты химических процессов. В термохимических расчетах обычно используют ряд следствий из закона Гесса:
1. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье – Лапласа).
Смотрите также
Лакокрасочные материалы. Общие понятия
Лакокрасочные материалы (ЛКМ) - это многокомпонентные составы
(жидкие, пастообразные или порошкообразные), которые при нанесении тонким слоем
на твердую подложку высыхают с образованием лако ...
Иод (Iodum), I
Иод - химический элемент VII группы периодической системы Менделеева, относится к галогенам (в литературе встречается также символ J); атомный номер 53, атомная масса 126,9045; кристаллы черно-серого ...
Гафний (Hafnium), Hf
Гафний - химический элемент IV группы периодической системы Менделеева; порядковый номер 72, атомная масса 178, 49; серебристо-белый металл. В состав природного Г. входят 6 стабильных изотопов с массо ...
