Построение графиков равновесной и рабочей линии процессаНовости химии / Абсорбция аммиака / Построение графиков равновесной и рабочей линии процесса
В состоянии равновесия в каждом конкретном случае существует строго определенная зависимость между концентрациями распределяемого вещества, которая при равновесии системы называется равновесной.
Очевидно, что любой концентрации X соответствует равновесная концентрация Y* и, наоборот, любой концентрации Y соответствует равновесная концентрация X*, т. е.
X = f(Y*); Y = f(X*).
В состоянии равновесия, при условии постоянства температуры и общего давления, зависимость между концентрациями распределяемого в газовой и жидкой фазах компонента будет однозначной. Эта зависимость выражается законом Генри: при постоянной температуре парциальное давление растворенного газа пропорционально его молярной доле в растворе или растворимость газа в жидкости при данной температуре пропорциональна его парциальному давлению над жидкостью.
Определяем коэффициент распределения, выраженный в мольных долях по формуле [1,c. 56]:
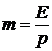 (2.2.1)
(2.2.1)
где Е - коэффициент Генри, МПа∙кмоль/кмоль (Е = 0,0016∙106 мм.рт.ст.= =0,213 МПа);
р - абсолютное давление МПа.
Подставляя данные в формулу (2.2.1) получим:
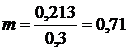 кмоль/кмоль
кмоль/кмоль
Определяем максимально возможную конечную равновесную концентрацию ![]() , кмоль/кмоль аммиака в воде, покидающей насадочный абсорбер. Она равновесна концентрации
, кмоль/кмоль аммиака в воде, покидающей насадочный абсорбер. Она равновесна концентрации ![]() , кмоль/кмоль по формуле [1,c. 56]:
, кмоль/кмоль по формуле [1,c. 56]:
![]() (2.2.2)
(2.2.2)
Подставляя данные в формулу (2.2.2) получим:
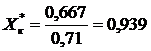 кмоль/кмоль
кмоль/кмоль
Выразим максимально возможную конечную равновесную концентрацию ![]() , кмоль/кмоль аммиака в воде, покидающей насадочный абсорбер в относительных массовых единицах по формуле [1,c. 57]:
, кмоль/кмоль аммиака в воде, покидающей насадочный абсорбер в относительных массовых единицах по формуле [1,c. 57]:
![]() (2.2.3)
(2.2.3)
Подставляя данные в формулу (2.2.3) получим:
![]() кг/кг
кг/кг
Определяем коэффициент распределения, выраженный в массовых долях по формуле [1,c. 57]:
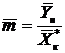 (2.2.4)
(2.2.4)
Подставляя данные в формулу (2.2.4) получим:
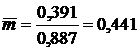 кг/кг
кг/кг
Определяем по линиям равновесия равновесные концентрации аммиака в отбросных газах соответствующие количеству аммиака в удаляемой воде по формулам [1,c. 58]:
![]() (2.2.5)
(2.2.5)
![]() (2.2.6)
(2.2.6)
Подставляя данные в формулы (2.2.5),(2.2.6) получим:
![]() кг/кг
кг/кг
![]() кмоль/кмоль
кмоль/кмоль
По найденным данным строим рабочую и равновесную линии в относительных массовых (рис. 2.2.1) и относительных мольных (рис. 2.2.2) координатах.
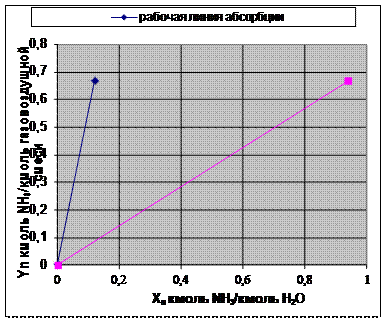
Рисунок 2.2.1 – Рабочая и равновесная линии в относительных мольных координатах.
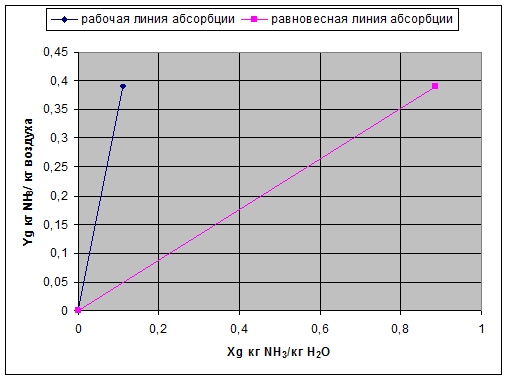
Рисунок 2.2.2 – Рабочая и равновесная линии в относительных массовых координатах.
