ЭМА без применения электролиза, кондуктометрия прямая и косвенная (кондуктометрическое титрование)Материалы / ЭМА без применения электролиза, кондуктометрия прямая и косвенная (кондуктометрическое титрование)Страница 2
Процессы, при которых отдача или присоединение электронов происходит на электродах, называются электродными.
Нернстом была получена формула, связывающая разность внутренних потенциалов ДЭС с активностями (концентрациями) частиц, участвующих в обратимом редоксипереходе:
![]() ,
,
где (Me) - потенциал заряженного слоя твердой фазы;
(раствор) - потенциал прилегающего к твердой фазе слоя раствора;
0 - константа, равная разности (Me) - (р-р), при ![]() (Ох) =
(Ох) = ![]() (Red) = 1 моль/л;
(Red) = 1 моль/л;
R - универсальная газовая постоянная (8,31 Дж/К моль);
T - температура, К;
F - число Фарадея (96 488 Кл/моль);
Z - число электронов, участвующих в редоксипереходе; ![]() (Ох) и
(Ох) и ![]() (Red) - активности окисленной (Ох) и восстановленной (Red) форм вещества в редоксипереходе, моль/л.
(Red) - активности окисленной (Ох) и восстановленной (Red) форм вещества в редоксипереходе, моль/л.
Установить внутренние потенциалы отдельных фаз (Me) и (р - р), к сожалению, экспериментально нельзя. Любая попытка подключить раствор с помощью провода к измерительному устройству, вызывает появление новой поверхности соприкосновения фаз металл-раствор, то есть возникновение нового электрода со своей разностью потенциалов, влияющей на измеряемую.
Однако можно измерить разность (Me) - (р - р) с помощью гальванического элемента. Гальваническим элементом называется система, составленная из двух разных электродов, обладающая способностью самопроизвольно преобразовывать химическую энергию протекающей в нем окислительно-восстановительной реакции в электрическую энергию. Электроды, из которых составлен гальванический элемент, называются полуэлементами. Протекающая в гальваническом элементе окислительно-восстановительная реакция пространственно разделена. Полуреакция окисления протекает на полуэлементе, называемом анодом (отрицательно заряженном электроде), а полуреакция восстановления - на катоде.
Кондуктометрия - это метод, основанный на измерении электропроводности анализируемого раствора.
Электропроводностью W называют величину, обратную электросопротивлению R: W = 1/R, [Ом-1 = См (Сименс)].
Растворы электролитов, являясь проводниками II рода, подчиняются закону Ома: R = U/I. Чтобы измерить сопротивление раствора, в него погружают электроды и подают внешнее напряжение U. По аналогии с проводниками I рода сопротивление раствора прямо пропорционально расстоянию между электродами l и обратно пропорционально площади их поверхности S: ![]() , где - удельное сопротивление, Ом/см;
, где - удельное сопротивление, Ом/см;
= R при l = 1 cм и S = 1см2, т.е. - сопротивление 1 см3 (мл) раствора.
Величину, обратную , называют удельной электропроводимостью (): = 1/r, [Cм см-1]. Величина равна электропроводности 1 см3 (мл) раствора, находящегося между электродами с площадью поверхности 1 см2, удаленными друг от друг на расстоянии 1 см.
Из закона Ома следует, что численно равна току, проходящему через слой электролита с S = 1 см2 под действием градиента потенциала 1В на единицу длины.
Электрическая проводимость разбавленных растворов электролитов зависит от суммарного числа ионов в растворе (то есть концентрации) числа элементарных зарядов, переносимых каждым ионом (то есть заряда иона) и от скорости движения одинаково заряженных ионов к катоду или аноду под действием электрического поля. С учетом этих факторов электропроводящие свойства ионов характеризуются эквивалентной электропроводимостью (). Ею называют проводимостью раствора, содержащего 1 моль вещества эквивалента и находящегося между двумя параллельными электродами, расстояние между которыми 1 см.
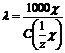 , [См см2/моль].
, [См см2/моль].
уменьшается с увеличением концентрации за счет увеличения межионных взаимодействий. В бесконечно разбавленных растворах приобретает постоянное и максимальное значение : = + + - , где + и - подвижность катионов и анионов раствора. Подвижность - это величина, относящаяся к эквиваленту иона (то есть частице с единичным зарядом, например, K+, ½ Mg2+, Al3+ и т.п.) и равна произведению абсолютной скорости движения иона на число Фарадея.
Ячейка для измерения электрической проводимости состоит из двух параллельных пластинчатых платиновых электродов, впаянных в стеклянный сосуд, на некотором расстоянии друг от друга.
При измерении электропроводности прохождение тока вызывает химические реакции (электролиз), которые могут производить изменение состава раствора у электрода и вызывать поляризацию электродов. Это может являться источником погрешностей при измерениях. Во избежание этого электропроводность измеряют при переменном токе. Незначительная поляризация постоянно уничтожается при перемене направления тока. Поляризацию уничтожает также платинирование электродов, т.е. покрытие их тонкоизмельченной платиной (платиновой чернью), увеличивающей поверхность электродов.
Смотрите также
Мышьяк (Arsenicum), As
Мышьяк - химический элемент V группы периодической системы Менделеева, атомный номер 33, атомная масса 74,9216; кристаллы серо-стального цвета. Элемент состоит из одного устойчивого изотопа 75As.
Ис ...
Технеций (Technetium), Те
Технеций был предсказан как эка-марганец Менделеевым на основе его Периодического закона. Несколько раз он был ошибочно открыт (как люций, ниппоний и мазурий), настоящий технеций был открыт в 1937 год ...
Технеций
Технеций
Технеций (лат. Technetium), Тс,
радиоактивный химический элемент VII группы периодической системы Менделеева,
атомный номер 43, атомная масса 98, 9062; металл, ковкий и пласт ...
