Сравнение свойств элементов IА и IIА
(комплексообразование, образование осадков) на примере Na, K и Mg, CaМатериалы / Элементы s-блока периодической системы / Сравнение свойств элементов IА и IIА
(комплексообразование, образование осадков) на примере Na, K и Mg, CaСтраница 1
Атомы элементов I
Агруппы имеют по одному валентному электрону на s подуровне внешнего энергетического уровня. Это обуславливает проявление степени окисления +1.
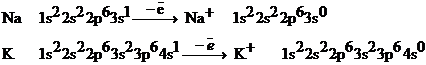
Все элементы I
Агруппы сходны по свойствам, что объясняется однотипным строением не только внешней, валентной оболочки, но и предвнешней (исключение литий).
С ростом радиуса атома в группе I
Аослабевает связь валентного электрона с ядром. Соответственно, уменьшается энергия ионизации атомов. Так как радиус атома калия больше, чем радиус атома натрия, то энергия ионизации калия меньше, чем у натрия.
В результате ионизации образуются катионы Э+, имеющие устойчивую конфигурацию благородных газов.
Химическая активность металлов I
Агруппы возрастает закономерно с увеличением радиуса атома и уменьшением их способности к гидратированию (чем меньше способность к гидратированию, тем активнее металл).
Так как радиус атома калия больше, чем радиус атома натрия, то способность к гидратации для катиона калия будет ниже, чем для катиона натрия, а, следовательно, химическая активность катиона калия выше, чем у катиона натрия.
Вследствие незначительного поляризующего действия (устойчивая электронная структура, большие размеры, малый заряд ядра) комплексообразование для ионов щелочных металлов малохарактерно. Вместе с тем, они способны образовывать комплексные соединения с некоторыми биолигандами (КЧ для натрия и калия может принимать значения 4 и 6). Способность образовывать донорно-акцепторные связи с соответствующими лигандами едва намечается у натрия. У калия имеется значительная тенденция к использованию имеющихся в атоме вакантных d-орбиталей.
Например, образование комплексов калия с антибиотиком валиномицином. Валиномицин образует с калием прочные комплексы, связывание этого антибиотика с натрием очень незначительно.
Большинство солей щелочных металлов хорошо растворимы в воде (исключение составляют некоторые соли лития).
Атомы элементов II
Агруппы имеют по два валентных электрона на s подуровне внешнего энергетического уровня.
В нормальном состоянии у атомов этих элементов нет неспаренных электронов, но при переходе атомов в возбужденное состояние один из s валентных электронов переходит на р-подуровень. Это обуславливает проявление степени окисления +2.
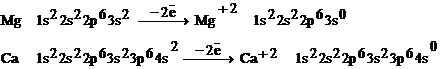
Степени окисления больше +2 элементы II
Агруппы не проявляют.
Несмотря на то, что число валентных s электронов у атомов II
Агруппы одинаково, свойства магния
и кальция
отличаются друг от друга.
Это связанно с тем, что в атоме кальция, в отличие от атома магния, имеются свободные d-орбитали, близкие по энергии к ns орбиталям.
Магний и кальций существенно различаются размерами атомов и ионов:
· металлический радиус атома Mg = 160 пм;
· металлический радиус атома Ca = 197 пм.
· кристаллический радиус иона Mg2+ = 74 пм;
· кристаллический радиус иона Ca2+ = 104 пм
Больший размер иона кальция обусловливает и более высокое координационное число этого иона – КЧ (Ca2+) 6, 8, тогда как КЧ (Mg2+) – 6. Прочность комплексных соединений уменьшается по мере увеличения радиуса атома, следовательно, комплексные соединения магния будут более прочными, чем комплексные соединения кальция. Ион Mg2+ образует шестикоординационные соединения регулярной структуры. Ca2+ образует несимметричные комплексы. Кальций предпочтительно координируется с атомами кислорода, магний – с атомами азота.
Многие соли щелочноземельных металлов малорастворимы в воде (малорастворимы CaF2, MgF2; практически не растворимы фосфаты кальция и магния). Причем с ростом порядкового номера растворимость солей снижается.
Такой характер изменения растворимости солей играет важную роль в биологическом действии катионов этой группы. Уменьшение растворимости кальция фосфата и карбоната по сравнению с фосфатами и карбонатами магния является, по видимому, одной из причин формирования скелета всех живых организмов именно из этих соединений кальция.
Смотрите также
Медь и её природные соединения, синтез малахита
Синтезировать
5 г. Малахита, рассчитать практический выход продукта, научиться пользоваться
необходимой литературой, выбирать из неё необходимую информацию, и представлять
полученные резуль ...
Углерод и его свойства
Углерод (лат. Carboneum),
С - химический элемент IV группы периодической системы Менделеева. Известны два стабильных
изотопа 12С (98,892 %) и 13С (1,108 %).
Углерод известен
с глубокой ...
