Взаимодействие хлорида железа (III) с хлоридом аммонияМатериалы / Химический эксперимент по неорганической химии в системе проблемного обучения / Взаимодействие хлорида железа (III) с хлоридом аммония
Хлорид Fe (III) проявляет окислительные свойства по отношению к различным восстановителям. В беседе предшествующей проведению опыта, перед учащимися ставим вопрос: возможно ли химическое взаимодействие между двумя кристаллическими солями хлоридом железа трехвалентного и хлоридом аммония? В поиске ответа на данный вопрос ученики обращаются к таблице растворимости, так как, им известно, что соли взаимодействуют между собой при условии, что они хорошо растворимы, а в результате реакции обмена получается новая нерастворимая соль. В процессе беседы учитель поясняет, что таблицу растворимости в данном случае, при использовании кристаллических вещест, применять нельзя. Таким образом, предварительное обсуждение приводит учащихся к выводу о невозможности химического взаимодействия между указанными веществами.
Далее проводим эксперимент. Он представляет интерес не только для выяснения окислительных свойств хлорида железа (III), но и как способ получения азота в лабораторных условиях.
Ход опыта:
В соответствии с стехиометрическими коэффициентами в уравнении реакции: 6FeCl3 + 2NH4Cl = 6FeCl2 + 8HCl + N2, учитель готовит смесь кристаллических солей хлорида железа (III) и хлорида аммония. Эту смесь помещают в колбу Вюрца, которую соединяют с двумя склянками Дрекселя, заполненными водой (рис. 1). Промывные склянки необходимы для того, чтобы поглотить выделяющийся в ходе реакции хлороводород. Соблюдая технику безопасности, проводят нагревание. Образовавшийся азот можно собрать в 2-3 пробирки над водой.
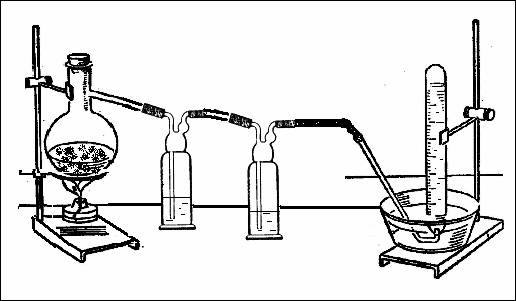
Рис. 1. Взаимодействие хлорида железа (III) с хлоридом аммония
Далее проверяем отсутствие примеси хлороводорода, поднеся влажную индикаторную бумагу к отверстию пробирки с азотом. Она не изменяет цвет. Проводим опыт подтверждающий, что собранный газ действительно азот.
а) В первую пробирку с азотом опускаем горящую лучинку она гаснет, не оставляя даже раскаленного уголька.
б) Во вторую – наливаем известковую воду, в отличие от углекислого газа, известковая вода от азота не мутнеет.
Доказав учащимся, что получен азот, отвергаем их мнение о невозможности взаимодействия хлорида железа (III) с хлоридом аммония.
Создается проблемная ситуация. Далее ученики должны выдвинуть свои предположения о роли каждого вещества в данной химической реакции. Анализ состава исходных веществ и результатов опыта приводит к выводу, что хлорид железа (III) выступает в роли окислителя, а соль аммония, имея в своем составе атомы азота в низшей степени окисления (– 3), проявляет восстановительные свойства. Подтверждаем этот вывод и напоминаем учащимся другие примеры проявления данными веществами указанных свойств. Затем предлагаем учащимся самостоятельную работу по составлению уравнения окислительно-восстановительной реакции между хлоридом железа (III) и хлоридом аммония. При составлении уравнения реакции учащиеся должны учесть, что один из продуктов реакции – хлороводород.
6FeCl3 + 2NH4Cl = 6FeCl2 + 8HCl + N2
Fe3+ + e- ® Fe2+ | 6
2N3- - 6e- ® N20 | 1
Смотрите также
Три теории деформационного учета монокристаллов
Среди многих неясных вопросов в проблеме пластичности монокристаллов
вопрос о природе деформационного упрочнения, которое состоит в увеличении
сопротивляемости кристалла пластической деформ ...
Исследование и разработка новых сорбентов
Развитие
науки на пороге XXI века
было бы невозможно себе представить без введения и использования новых
технологий. Одной из развивающихся и прогрессирующих наук в наше время является
био ...
Синтез нитрата 1-окси-3-адамантанкарбоновой кислоты
Целью данной
курсовой работы является синтезирование нитрата 1-окси-3-адамантановой кислоты
и изучение её свойств.
Как и для большинства карбоцепных и гетероцепных
полимеров, исходными в ...
