Закон соответственных состоянийМатериалы / Химические методы анализа / Закон соответственных состояний
Одно из центральных положений теорий термодинамического подобия – закон соответственных состояний возникла как следствие из приведенного уравнения Ван-дер-Вальса:
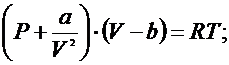 (для 1-го моля вещества)
(для 1-го моля вещества)
a = 3PkVk2; b = 1/3 Vk;
где Р, Рк – давление и критическое давление;
V, Vk – обьем мольный и критический мольный обьем;
Т, Тк - температура и критическая температура;
a, b – постоянные Ван-дер-Вальса;
R – универсальная газовая постоянная;
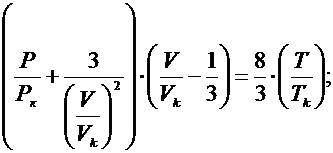
Отношение параметра к критическому параметру – приведенный параметр:
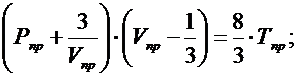 (1) – приведенное уравнение Ван-дер-Вальса;
(1) – приведенное уравнение Ван-дер-Вальса;
Состояние веществ с одинаковыми значениями приведенных параметров наз. Соответствующими состояниями.
Уравнение (1) отсутствует параметр относящийся к конкретному веществу, поэтому можно ожидать, что оно выполняется для определений совокупности веществ, следует, что из (1) при равенстве двух приведенных параметров нескольких веществ, третий приведенный параметр также должен быть одинаковым для всех веществ – закон соответственных состояний.
Смотрите также
Лигнин
В
технологии переработки древесной зелени под хвойной древесной зеленью понимают
– хвойную лапку, то есть охвоенные побеги, таким образом, хвойная древесная
зелень представляет собой смесь ...
