Химическая кинетика и равновесиеМатериалы / Химическая кинетика и равновесиеСтраница 1
Химическая кинетика – раздел химии, который изучает скорость химической реакции и факторы влияющие на неё.
О принципиальной осуществимости процесса судят по значению изменения энергии Гиббса системы. Однако оно ничего не говорит о реальной возможности реакции в данных условиях, не даёт представления о скорости и механизме процесса.
Изучение скоростей реакций позволяет выяснить механизм сложных химических превращений. Это создаёт перспективу для управления химическим процессом, позволяет осуществлять математическое моделирование процессов.
Реакции могут быть:
1. гомогенными – протекают в одной среде (в газовой фазе); проходят во всём объёме;
2. гетерогенными – протекают не в одной среде (между веществами, находящимися в разных фазах); проходят на границе раздела.
Под скоростью химической реакции понимают число элементарных актов реакции, проходящих в единицу времени в единице объёма (для гомогенных реакций) и на единицу поверхности (для гетерогенных реакций).
Так как при реакции изменяется концентрация реагирующих веществ, то скорость обычно определяют как изменение концентрации реагентов в единицу времени и выражают в ![]() . При этом нет необходимости следить за изменением концентрации всех веществ, входящих в реакцию, поскольку стехиометрический коэффициент в уравнении реакции устанавливает соотношение между концентрациями, т.е. при
. При этом нет необходимости следить за изменением концентрации всех веществ, входящих в реакцию, поскольку стехиометрический коэффициент в уравнении реакции устанавливает соотношение между концентрациями, т.е. при ![]() скорость накопления аммиака вдвое больше скорости расходования водорода.
скорость накопления аммиака вдвое больше скорости расходования водорода.
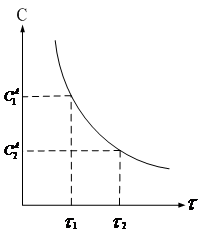
![]()
![]() ,
, ![]() , т.к.
, т.к. ![]() не может быть отрицательной, поэтому ставят «–».
не может быть отрицательной, поэтому ставят «–».
![]()
![]()
![]()
Скорость в интервале времени ![]() – истинная мгновенная скорость – 1‑ая производная концентрации по времени.
– истинная мгновенная скорость – 1‑ая производная концентрации по времени.
Скорость химических реакций зависит:
1. от природы реагирующих веществ;
2. от концентрации реагентов;
3. от катализатора;
4. от температуры;
5. от степени измельчения твёрдого вещества (гетерогенные реакции);
6. от среды (растворы);
7. от формы реактора (цепные реакции);
8. от освещения (фотохимические реакции).
Основной закон химической кинетики – закон действующих масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в реакции
![]() :
: ![]() ,
,
где ![]() – постоянная скорости химической реакции
– постоянная скорости химической реакции
Физический смысл ![]() при
при ![]() .
.
Если в реакции участвуют не 2‑е частицы, а более ![]() , то:
, то: ![]() ~
~![]() в степенях, равных стехиометрическим коэффициентам, т.е.:
в степенях, равных стехиометрическим коэффициентам, т.е.: ![]() , где
, где
Смотрите также
Помутнение как характеристическое свойство оксиэтилированных ПАВ и полимеров
...
Очистка воды на ионитных фильтрах
Вода - это великая ценность, которую человек
получил в дар от природы. Ее надо оберегать и уметь рационально использовать.
Потребление некачественной воды может нанести непоправимый вред здо ...
Комплексные соединения, их биологическая роль (на примере хлорофилла и гемоглобина)
...
