Способы определения порядка реакции и константы скорости. Способ
избыточных концентрацийМатериалы / Скорость образования, расходования компонента и скорость реакции / Способы определения порядка реакции и константы скорости. Способ
избыточных концентраций
Для реакции
v1А1 + v2A2→Продукты (22)
зависимость скорости от концентрации исходных веществ записывается уравнением:
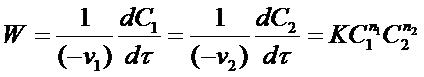 (23)
(23)
где С1 и С2 - концентрации исходных веществ А1 и А2;
п1 и п2 - порядки реакции по веществам А1 и А2;
К - константа скорости реакции. Общий (суммарный) порядок реакции равен:
п = п1 + п2 (24)
Если реакция элементарная и формально простая и подчиняется кинетическому уравнению для элементарных реакций, то порядок реакции по веществам А1 и А2 равен их стехиометрическим коэффициентам в уравнении реакции, то есть
п1=v1 и п2=v2
тогда п = v1+ v2
Для определения порядка химической реакции сначала, по экспериментальным результатам изменения концентрации исходных веществ со временем, находят порядки реакции по веществам. Затем общий порядок реакции.
Для того чтобы скорость реакции зависела в явном виде только от концентрации одного из исходных веществ, обычно используют способ избыточных концентраций или метод изолирования Оствальда
.
Он заключается в следующем.
Сначала проводят реакцию, когда концентрация исходного вещества А2 избыточна по сравнению с веществом А1. При протекании реакции считают, что меняется только концентрация вещества А1 (обычно она в 10 .1000 раз меньше концентрации остальных веществ), а концентрация вещества А2 практически постоянна и её можно ввести в постоянный коэффициент. При этом уравнение (23) примет вид:
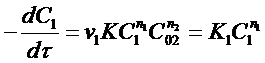 (25)
(25)
где 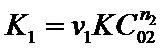 - константа скорости реакции по веществу А1.
- константа скорости реакции по веществу А1.
Затем проводят реакцию при избытке вещества А1 по сравнению с веществом А2. Тогда уравнение (23) преобразуется к виду:
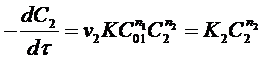 (26)
(26)
где ![]() - константа скорости реакции по веществу А2.
- константа скорости реакции по веществу А2.
Если удастся определить величины п1 и п2 , то можно будет найти общий порядок реакции по формуле (24) и константы скорости К1 и К2 , а затем константу скорости реакции по формуле:
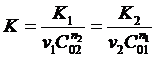
Иногда при проведении опытов используют метод, в котором концентрацию одного из исходных веществ изменяют, а концентрацию другого вещества оставляют постоянной.
Способы расчета порядка реакции по данному веществу подразделяются на дифференциальные и интегральные. Рассмотрим некоторые из них.
Смотрите также
Водород (Hydrogenium), Н
Водород - химический элемент, первый по порядковому номеру в периодической системе Менделеева; атомная масса 1,00797. При обычных условиях В. - газ; не имеет цвета, запаха и вкуса.
Историческая ...
Создание безотходной технологии в производстве кальцинированной соды
В настоящее
время трудно себе представить какую-нибудь отрасль какой-либо страны, где бы не
применялась сода или продукты из неё. Крупнейшими потребителями соды являются
такие отрасли, как ...
Изотермы адсорбции паров летучих органических веществ на пористых углеродных материалах
Антропогенные
изменения окружающей среды становятся все более значимыми по мере усиления
хозяйственной деятельности человека. Научно – технический прогресс ведет к
заметным, иногда непредск ...
