Механизм реакции этерификацииМатериалы / Синтез изоамилового эфира уксусной кислоты реакцией этерификации (гидролиза) сложных эфиров / Механизм реакции этерификации
Роль катализатора заключается в протонировании карбонильного кислорода: при этом карбонильный атом углерода становится более положительным и более «уязвимым» по отношению к атаке нуклеофильного агента, которым является молекула спирта. Образующийся вначале катион (VIII) присоединяет молекулу спирта за счет неподеленных электронов кислородного атома, давая катион (IX):
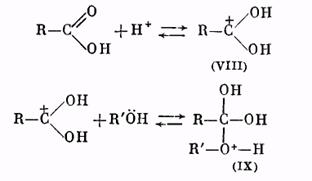
Далее катион (IX) отщепляет молекулу воды, превращаясь в катион сложного эфира (X):
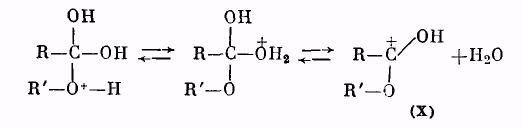
Катион (X) в результате отщепления протона образует молекулу сложного эфира:
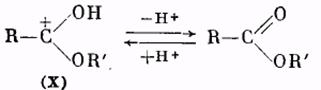
Использование метода «меченых атомов» дало возможность решить вопрос о месте разрыва связей при реакции этерификации. Оказалось, что обычно молекула воды образуется из гидроксила кислоты и водорода спирта. Следовательно, в молекуле кислоты разрывается связь между ацилом и гидроксилом, а в молекуле спирта — связь водорода с кислородом. Такой именно вывод следует из результатов работы по этерификации бензойной кислоты метанолом, содержащим тяжелый изотоп кислорода О18. Полученный сложный эфир содержал в своем составе указанный изотоп кислорода:
Присутствие О18 установлено сжиганием образца эфира и анализом образующихся продуктов сгорания (CO2 и Н2О) на присутствие тяжелого изотопа кислорода.
Гидролиз сложных эфиров представляет собой реакцию, обратную реакции их образования. Гидролиз может быть осуществлен как в кислой, так и в щелочной среде. Для кислого гидролиза сложных эфиров справедливо все, что было сказано выше применительно к реакции этерификации, об обратимости и механизме процесса, о методах смещения равновесия. Щелочной гидролиз сложных эфиров проходит через следующие стадии:
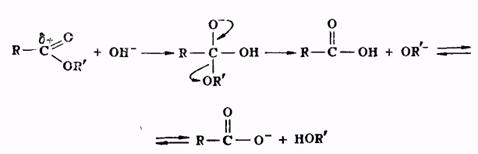
Он является процессом необратимым, поскольку богатый электронами анион кислоты не способен взаимодействовать с нуклеофильной молекулой спирта.
Практически щелочной гидролиз сложных эфиров проводят в присутствии едких щелочей КОН, NaOH, а также гидроокисей щелочноземельных металлов Ва(ОН)2, Са(ОН)2 Образующиеся при гидролизе кислоты связываются в виде солей соответствующих металлов, поэтому гидроокиси приходится брать по крайней мере в эквивалентном отношении со сложным эфиром. Обычно используют избыток основания. Выделение кислот из их солей осуществляется с помощью сильных минеральных кислот.
В качестве растворителя основания для реакции гидролиза чаще всего применяют воду, которая, однако, не растворяет сложный эфир. Реакция идет на поверхности раздела двух фаз и требует поэтому хорошего перемешивания. Иногда реакцию бывает целесообразно проводить в гомогенной среде, используя в качестве растворителя водный спирт. При этом, однако, нужно иметь в виду, что для выделения кислоты перед подкислением раствора спирт необходимо удалить (отогнать).
Смотрите также
Олово (Stannum), Sn
Олово - химический элемент IV группы периодической системы Менделеева; атомный номер 50, атомная масса 118,69; белый блестящий металл, тяжёлый, мягкий и пластичный. Элемент состоит из 10 изотопов с ма ...
Скорость химической реакции
Вокруг нас постоянно происходят тысячи химических реакций. Горит
костер и горит газ в конфорке газовой плиты, ржавеет железо, молоко
превращается в творог, на фотопленке возникают изображени ...
Стекло
...
