Кондуктометрическое определение хлорид ионовМатериалы / Методы определения хлорид-ионов / Кондуктометрическое определение хлорид ионов
Кондуктометрия – электрохимический метод анализа, связывающий электропроводность раствора с его составом. Электрическая проводимость растворов обусловлена наличием в них носителей электрического заряда – ионов. Все растворимые соли диссоциируют на ионы, поэтому проводимость ионных раствором значительно выше молекулярных.
Для определения хлоридов в объектах окружающей среды прямая кондуктометрия применяться не может. Прямая кондуктометрия заключается в определении электропроводности раствора содержащего определяемый компонент. Линейный характер носит только электропроводность индивидуальных растворов, либо смесей с точно известными концентрациями. Объекты окружающей среды кроме хлорид-ионов, содержат и другие, влияющие на электропроводность раствора. По этой причине для определения хлоридов используется метод кондуктометрического титрования.
Кондуктометрическое титрование используется при определении индивидуальных веществ и анализе разнообразных смесей. Точку эквивалентности при кондуктометрическом титровании определяют по изменению электропроводности раствора. Электропроводность измеряют после добавления каждой порции титранта. Зависимость электропроводности раствора от количества добавленного титранта изображают графически. Полученный график называют кривой кондуктометрического титрования. Кондуктометрические кривые имеют излом, соответствующий точке эквивалентности.
Кривые подобного типа могут быть использованы для аналитических целей только в том случае, если перед точкой зквивалентности наблюдается линейное изменение проводимости.
При титровании следует проводить большое число измерений электропроводности. Для определения точки эквивалентности используют близкие к ней участки кривых.
В методе кондуктометрического титрования могут применяться реакции осаждения:
Ag+ +NО3- + Na+ + Cl- → ↓AgCI + Na+ + NO3-
Изменение состава ионов приводит к изменению электропроводности раствора.
Поскольку реакции осаждения часто протекают не мгновенно, измерение сопротивления раствора при титровании следует проводить после достижения постоянной проводимости.
При кондуктометрическом титровании необходимо, прежде всего, чтобы излом кондуктометрической кривой позволял устанавливать точку эквивалентности с достаточной точностью. Чем острее угол излома, тем выше точность. Когда угол излома очень тупой, установление точки эквивалентности затруднено.
Для кондуктометрического определения хлорид ионов широко применяется титрование нитратом серебра. Однако этот реагент осаждает также Br-, I-, SCN-, СгО4 – С2О42-, тартрат, цитрат и другие анионы. Титрование сопровождается образованием малорастворимых солей серебра. Изменение проводимости растворов при титровании до точки эквивалентности, зависит от сравнительной подвижности осаждаемых анионов и заменяющих их в растворе NO3 ионов. При титровании С1 – (λ0= 76,4), Вr – (λ0=78,1), I – (λ0=78,8) и CrO42 – (λ0= 85) проводимость понижается, так как подвижности этих ионов выше подвижности NO3 – (λ0=71,5). Однако при титровании SCN – (λ0=57,4), наоборот, происходит небольшое повышение проводимости, так как его подвижность ниже подвижности NO3-.
В зависимости от растворимости солей серебра изменяются концентрации титруемых растворов, при которых удается проводить определения с достаточно высокой точностью. Так, титрование хлоридов можно проводить и в очень разбавленных растворах при концентрации С1 – 0,025 мг/мл и меньше. Это титрование используется для определения С1- в питьевой воде. Между тем I – можно титровать, в растворах, концентрация которых больше 0,005 н., а цитраты только при концентрации не ниже 0,1 н.
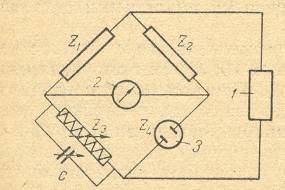
Z1, Z2, Z3, Z4 – плечи мостика, С – переменная ёмкость, 1 – генератор звуковой частоты, 2 – гальванометр, 3 – электролитическая ячейка.
Рисунок 2.4 – Мостик Уитстона
Электропроводность растворов может быть найдена, если измерить сопротивление электролитической ячейки. Для измерения сопротивления используют переменный ток звуковой частоты, так как постоянный вызывает разложение веществ находящихся в растворе.
Сопротивление раствора определяют путём сравнения с эталонным сопротивлением. Для этого служит мостик Уитстона (рисунок 2.4). Сопротивления Z1, Z2, Z3, Z4 можно подобрать так, чтобы ток в диагонали моста отсутствовал, т.е. сопротивления каждой ветви были пропорциональны. Измеряемое сопротивление определяют по формуле:
Z4=![]()
Где Z – сопротивления соответствующих плечей мостика.
Смотрите также
Технеций
Технеций
Технеций (лат. Technetium), Тс,
радиоактивный химический элемент VII группы периодической системы Менделеева,
атомный номер 43, атомная масса 98, 9062; металл, ковкий и пласт ...
Совершенствование технологии получения прядильного раствора в производстве ПАН волокон
На
рубеже второго и третьего тысячелетий волокна на основе полимеров и сополимеров
акрилоннтрила заняли 4-6% в общем балансе текстильного сырья.
Полиакрилонитрильные
(ПАН) волокна оказ ...
Франций (Francium), Fr
Этот элемент открыла (по его радиоактивности) в 1939 г. Маргарита Пере, сотрудница Института радия в Париже. Она же дала ему в 1964 г. название в честь своей родины — Франции.
Микроскопические к ...
