Расчет абсолютной энтропииМатериалы / Коллоидная химия / Расчет абсолютной энтропии
Рассчитаем изменение энтропии некоторой системы при нагревании её от абсолютного нуля до температуры T при постоянном давлении. Из первого и второго начал термодинамики имеем:
![]() (I.61)
(I.61)
![]() (I.62)
(I.62)
Отсюда:
![]() (I.63)
(I.63)
Учитывая, что ST=0 = 0, получим:
![]()
(I.64)
При T = 0 любое вещество может находиться только в твердом состоянии. При нагревании вещества возможен его переход в жидкое и затем в газообразное состояние; для фазовых переходов, происходящих в изобарно-изотермических условиях, изменение энтропии равно приведенной теплоте фазового перехода:
![]() (I.65)
(I.65)
Таким образом, нагревание вещества без фазовых переходов сопровождается непрерывным ростом энтропии; при фазовом переходе происходит скачкообразное изменение энтропии. Графическая зависимость энтропии вещества от температуры приведена на рисунке 1.3.
Учитывая это, рассчитать абсолютную энтропию любого вещества при любой температуре можно следующим образом:
![]() (I.66)
(I.66)
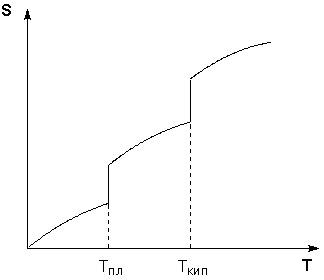
Рис. 1.3
Зависимость энтропии вещества от температуры.
Поскольку энтропия есть функция состояния, изменение энтропии в ходе химического процесса определяется только видом и состоянием исходных веществ и продуктов реакции и не зависит от пути реакции; оно может быть рассчитано по уравнению (I.67):
![]() (I.67)
(I.67)
Для многих веществ величины абсолютной энтропии в стандартных условиях приведены в справочной литературе.
Смотрите также
Аргон (Argon), Ar
В конце XIX века техника и наука обогатились созданием ряда инструментов для определения физико-химических свойств различных элементов. Развитие науки требовало точных знаний о свойствах веществ. Поэт ...
Критический объем и плотность веществ, их прогнозирование
...
