4. Изопроцессы в термодинамике. Энергия ГельмгольцаКниги / Физическая химия / ЛЕКЦИЯ № 2. Химическая термодинамика / 4. Изопроцессы в термодинамике. Энергия Гельмгольца
1. Изотермический
– Т= const
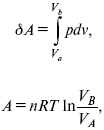
так как
![]()
2. Изохорный
– V = const
δА = 0,
δА = pdυ = 0,
δQ = dU + pdυ,
δQ = CvdT.
3. Изобарный
– P = const
δА = pdυ,
A = pV2 – pV1.
4. Адиабатический
– δQ = 0
1) δA = –dU,
A = –CV(T2 – T1), T2 > T1;
2) pd δ= –CvdT,
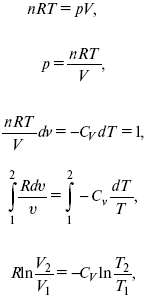
действие, обратное логарифму – потенцирование
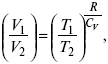
Уравнение первого закона термодинамики в калорических коэффициентах
δQ = ldυ + CVdT,
где l – коэффициент изотермического расширения;
CV – теплоемкость при постоянном объеме.
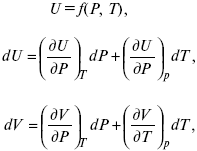
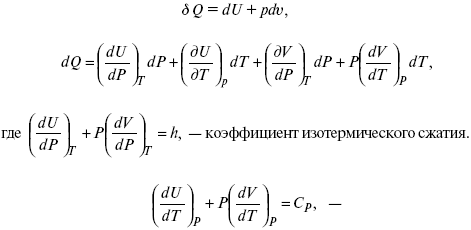
теплоемкость при const давлении,
δQ = hdP + CpdT ,
δQ = χdP + ψdυ.
Связь между функциями CP и CV
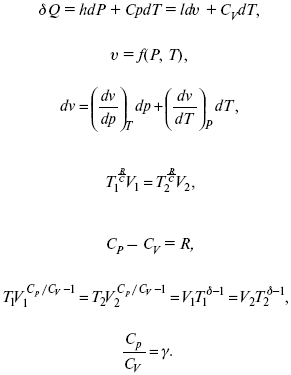
Смотрите также
Технологические иследования процесса массопереноса - диффузии
С процессом массопереноса - диффузией приходится сталкиваться
постоянно в явной или неявной форме в своей повседневной жизни, практической
деятельности, научных и технологических исследовани ...
Резерфордий (Rutherfordium), Rf
Резерфордий - искусственно полученный радиоактивный химический элемент IV группы периодической системы Менделеева, атомный номер 104. Известны только радиоактивные изотопы: 260Rf и 259Rf (периоды полу ...
Рений (Rhenium), Re
В 1929 г. английская фирма обратилась к директору далекого сибирского завода с предложением заключить необычное торговле соглашение. Фирма просила продать ей пустую породу - отбросы производства этого ...
