Константа равновесия, степень превращенияМатериалы / Кинетика химических реакций / Константа равновесия, степень превращения
Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия. Так, для обратимой реакции, которую в общем виде можно записать как
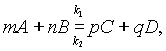
согласно закону действующих масс, скорости прямой реакции v1 и обратной v2 соответственно запишутся следующим образом:
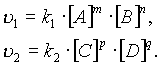
В момент достижения состояния химического равновесия скорости прямой и обратной реакций равны:
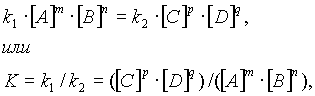
где К — константа равновесия, представляющая собой отношение констант скорости прямой и обратной реакций.
В правой части первого уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии, — равновесные концентрации.
Второе уравнение представляет собой математическое выражение закона действующих масс при химическом равновесии.
Этот закон является одним из наиболее важных в химии. Исходя из кинетического уравнения любой химической реакции, можно сразу же записать отношение, связывающее равновесные концентрации реагирующих веществ и продуктов реакции. Если определить константу К экспериментально, измеряя равновесные концентрации всех веществ при данной температуре, то полученное значение можно использовать в расчетах для других случаев равновесия при той же температуре.
Численное значение константы равновесия характеризует тенденцию к осуществлению реакции или, другими словами, характеризует выход данной реакции. Так, при К >> 1 выход реакции велик, так как при этом
![]()
Понятно, что при К << 1 выход реакции мал.
Смотрите также
Америций (Americium), Am
Америций - искусственно полученный радиоактивный химический элемент, относится к актиноидам, атомный номер 95. Стабильных изотопов не имеет. Синтезирован в конце 1944 - начале 1945 американскими учёны ...
Три теории деформационного учета монокристаллов
Среди многих неясных вопросов в проблеме пластичности монокристаллов
вопрос о природе деформационного упрочнения, которое состоит в увеличении
сопротивляемости кристалла пластической деформ ...
