Аналитические реакции катиона никеля (II) Ni2+Материалы / Качественный анализ (кислотно-основная классификация) / Аналитические реакции катиона никеля (II) Ni2+
Аквокомплексы никеля (II)[Ni(H2O)6]2+ окрашены в зеленый цвет, поэтому водные растворы солей никеля (II) имеют зеленую окраску. В растворе никель (II) присутствует только в форме комплексных соединений.
1.Реакция с щелочами.
Ni2+ + 2 ОН- -> Ni (ОН)2(зеленый)
Проба на растворимость. Осадок Ni(OH)2 растворяется в растворах кислот и аммиака: Ni(OH)2 + 2 Н+ -• №2+ + 2 Н2О
Ni(OH)2 +6 NH3 — [Ni(NH3)6]2+ + 3 ОН-
2.Реакция с аммиаком.
Ni(NO3)2 + NH3H2O — NiOHNO3 + NH4NO3,
NiCl2 + NH3H2O -- NiOHCl + NH4C1 2NiSO4 + 2 NH3H2O -- Ni(OH)2SO4 + (NH4)SO4,
Методика. В пробирку вносят 2-3 капли раствора соли хлорида никеля (II) Добавляют концентрированный (25%-й) раствор аммиака до полного растворения осадка и образования раствора синего цвета:
NiOHCl + 6 NH3 -> [Ni(NH3)6]2+ + ОН- + CY
Оксисоль Ni(II)гексамминникель (II) катион
Прибавляют к ней по каплям концентрированный раствор КВг до выпадения фиолетового осадка [Ni(NH3)6]Br2.
Комплексы [Ni(NH3)6]Ck [Ni(NH3)6](NO2)2, [Ni(NH3)6]SO4 хорошо растворяются в воде, а остальные мало растворимы в воде.
3.Реакция с реактивом Чугаева (диметилглиоксимом).
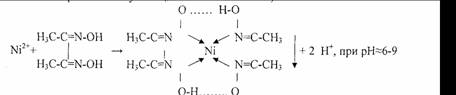
Розово-красный Бис-диметилглиоксиматоникель (II)
Реакцию проводят в среде аммиака.
Осадок растворяется в сильных кислотах и щелочах, нерастворим в растворах аммиака. Проведению реакции мешают катионы Cu2+, Pb2+, Fe2+, Fe3+.
Чувствительность реакции повышается в присутствии небольших количеств окислителей (бром, йод и др.), переводящих Ni (II) в Ni (III), комплекс которого имеет еще более интенсивную окраску.
4.Реакция с сульфид - ионами. -
Ni2+ + S2- -> NiS (черный)
5.Другие реакции катионов Ni (II).
Катионы Ni2+ с тиоцианатом калия KNCS и пиридином (Ру) образуют голубой осадок-комплекса состава [NiPy](NCS)2; со смесью щелочи и хлорной воды - черно-бурый осадок гидроксида Ni (III) Ni(OH)3; с рубеановодородной кислотой -сине-фиолетовый осадок рубеаната никеля малорастворимый в кислотах и аммиаке.
Смотрите также
Технология получения смолы 135
...
Ванадий (Vanadium), V
Этот элемент образует соединения с красивой окраской, отсюда и название элемента, связанное с именем скандинавской богини красоты Ванадис.
В промышленности при получении ванадия из железных руд с его ...
