Изотермы адсорбцииМатериалы / Изотермы адсорбции паров летучих органических веществ на пористых углеродных материалах / Изотермы адсорбции
Для практического применения адсорбционного процесса способность адсорбента поглощать определенный адсорбтив, так называемая адсорбционная способность, имеет решающее значение. Поэтому экспериментально определяется равновесная адсорбционная емкость при постоянной температуре как функция равновесной концентрации и соответственно парциального давления. Графическое изображение этой зависимости называется изотермой адсорбции. То есть температурная зависимость парциального давления адсорбтива при постоянной адсорбции. Вид изотермы адсорбции зависит от природы поглощаемого вещества и поглотителя и от температуры процесса. Например, один и тот же активный уголь можно отнести к типу I по адсорбции четыреххлористого углерода и к типу V по адсорбции паров воды.
В литературе приводится множество изотерм адсорбции. Однако все эти многочисленные изотермы, описывающие физическую адсорбцию, можно условно разбить на пять групп, соответствующих пяти группам классификации, первоначально предложенной Брунауэром, Демингом, Демингом и Теллером (БДДТ). Сейчас чаще ссылаются на классификацию Брунауера, Эммета и Теллера (БЭТ).
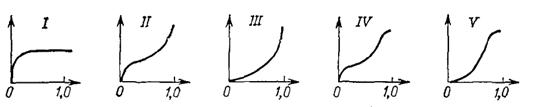
Рисунок 1 - Пять типов изотерм адсорбции по классификации (БДДТ)
Адсорбция вызывается действием силового поля у поверхности твердого тела (адсорбента), которое притягивает молекулы газа (адсорбата). Создаваемые твердым телом силы притяжения могут быть двух типов: физические и химические. Они обусловливают либо физическую адсорбцию, либо соответственно хемосорбцию. Количество адсорбированного вещества, приходящегося на 1г твердого тела, зависит от равновесного давления p, температуры T, а так же от природы газа и твердого тела. Следовательно,
x=ƒ (p,T,газ, тв. тело). (3)
Для газа, адсорбированного при фиксированной температуре на твердом теле, уравнение (3) принимает вид
x= ƒ (p),T,газ тв. тело . (4)
Если температура газа ниже его критической температуры, то есть он является паром, более удобна другая форма уравнения
x= ƒ (p|p0),T,газ тв. тело, (5)
где p0 – давление насыщенного пара адсорбата. Уравнения (4) и (5) представляют уравнения изотермы адсорбции, связывающее количество адсорбированного при фиксированной температуре на данном твердом теле данного газа с его давлением [8].
В соответствии с эмпирической классификацией, впервые предложенной Брунауэром, различают несколько основных типов изотерм адсорбции в зависимости от их вида. Тип I соответствует мономолекулярной адсорбции, остальные полимолекулярной. Изотерму I часто называют лэнгмюровской, так как уравнение Лэнгмюра описывает именно такие изотермы. Изотермы II типа называют S-образными. Остальные изотермы специальных названий не имеют. Для практического использования в адсорбционной технике представляют интерес преимущественно типы I, II и IV, поскольку при подобных видах изотерм достигаются высокие сорбционные емкости при низких концентрациях.
Лэнгмюр вывел уравнение изотермы адсорбции при допущении, что на любом участке поверхности взаимодействие между адсорбатом и адсорбентом имеет одинаковый характер
![]() (6)
(6)
где V-—объем адсорбированного газа; Vмоно — объем газа, необходимый для образования мономолекулярного покрытия на поверхности адсорбента; р — парциальное давление; k — константа.
Это уравнение не учитывает взаимодействия молекул адсорбата друг с другом. При очень низких значениях р произведение kp в знаменателе мало но сравнению с единицей, при этом адсорбция будет пропорциональна kp:
![]() (7)
(7)
При высоких парциальных давлениях единицей в выражении (6) можно пренебречь, тогда
![]() (8)
(8)
Это равенство является границей применимости уравнения Лэнгмюра, которое в основном применяется для описания адсорбции газа на микропористых сорбентах, в которых по пространственным причинам возможна только низкая степень покрытия.
Преобразованная форма уравнения (6)
![]() (9)
(9)
используется для описания процессов адсорбции по изотерме I типа в координатах p/V как функция р. В пределах применимости уравнения Лэнгмюра получают прямую с наклоном 1/Vмоно и отрезком 1/Vмоно k по оси p/V. Экспериментальное определение величин Vмоно позволяет при известных значениях посадочной площадки молекул адсорбтива определить площадь поверхности адсорбента.
На практике широкое применение находят расчетные методы потенциальной теории адсорбции. Это обусловлено тем, что с помощью уравнения Дубинина — Радушкевича по стандартной изотерме при известном коэффициенте аффинности можно рассчитать изотерму адсорбции и распределение размеров пор для любого пара или газа [9].
Смотрите также
Тепловой эффект химической реакции
Тепловые
эффекты химических реакций необходимы для многих технических расчетов. Они
находят обширное применение во многих отраслях промышленности, а также в
военных разработках.
Целью
д ...
Получение диметилового эфира дегидратацией метанола на АlPO4 +SiO2 катализаторах
...
Углерод (Carboneum), С
Углерод - химический элемент IV группы периодической системы Менделеева, атомный номер 6, атомная масса 12,011. Известны два стабильных изотопа: 12C (98,892%) и 13C (1,108%). Из радиоактивных изотопов ...
