Физические и химические свойства.Статьи / Углерод (С) / Физические и химические свойства.Страница 1
Известны четыре кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит. Графит - серо-чёрная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском, обладает электропроводимостью. Атомы расположены параллельными слоями, образуя гексагональную решетку. Внутри слоя атомы связаны сильнее, чем один слой с другим, поэтому графит может расслаиваться. Сгорает при 700єС в рисутствии кислорода. Встречается в природе; получается искусственно. При высокой температуре, давлении и рисутствии катализатора (марганец Mn, хром Cr, платиновые металлы) графит превращается в алмаз. Алмаз - минерал, имеющий желтоватый, белый, серый, зеленоватый, реже голубой и черный цвет. Не проводит электрический ток, плохо проводит тепло. В кристалле атомы углерода образуют непрерывный трехмерный каркас, состоящий из сочлененных тетраэдров, что обеспечивает высокую прочность связей. Алмаз - это самое твердое вещество из всех известных. Температура плавления выше 3500єС. Химически стоек. Сгорает при 870єС в присутствии кислорода. При 1800єС в отсутствие кислорода превращается в графит. Прозрачные кристаллы; после обработки - бриллианты. Добывают из россыпей и коренных месторождений. Синтетический алмаз получают из графита при высоких давлении и температуре. Он чаще полупрозрачный или непрозрачный; имеет кристаллическую структуру и свойства природного алмаза. Жидкий углерод может быть получен при давлениях выше 10,5 Мн/мІ (105 кгс/смІ) и температурах выше 3700єС. Кокс, сажа, древесный уголь (твердый углерод) имеют то же строение, что и графит.Для твёрдого углерода характерно также состояние с неупорядоченной структурой - так называемый "аморфный" углерод, который не представляет собой самостоятельной модификации; в основе его строения лежит структура мелкокристаллического графита. Нагревание некоторых разновидностей "аморфного" углерода выше 1500-1600єС без доступа воздуха вызывает их превращение в графит. Физические свойства "аморфного" углерода очень сильно зависят от дисперсности частиц и наличия примесей. Плотность, теплоёмкость, теплопроводность и электропроводность "аморфного" углерода всегда выше, чем графита. Карбин получен искусственно. Он представляет собой мелкокристаллический порошок чёрного цвета (плотность = 2 г/смі). Построен из длинных цепочек атомов С, уложенных параллельно друг другу. Лонсдейлит найден в метеоритах и получен искусственно; его структура и свойства окончательно не установлены.
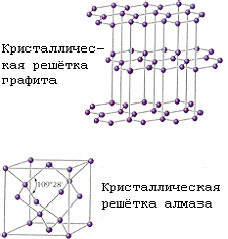
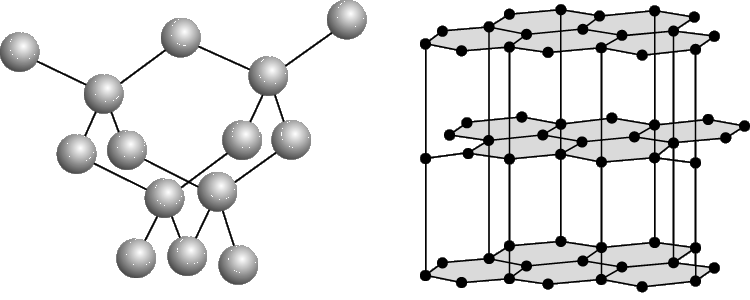
А Б
Структура алмаза (а) и графита (б).
Конфигурация внешней электронной оболочки атома углерода 2sІ2pІ. Для углерода характерно образование четырёх ковалентных связей, обусловленное возбуждением внешней электронной оболочки до состояния 2spі. Химическая связь может осуществляться за счет sp3-, sp2- и sp- гибридных орбиталей, которым соответствуют координационные числа 4, 3 и 2. Число валентных электронов углерода и число валентных орбиталей одинаково; это одна из причин устойчивости связи между атомами углерода.
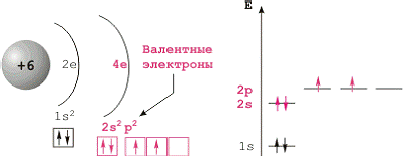
Строение атома углерода.
Уникальная способность атомов углерода соединяться между собой с образованием прочных и длинных цепей и циклов привела к возникновению громадного числа разнообразных соединений углерода (углеводородов), изучаемых органической химией.
Смотрите также
Олово (Stannum), Sn
Олово - химический элемент IV группы периодической системы Менделеева; атомный номер 50, атомная масса 118,69; белый блестящий металл, тяжёлый, мягкий и пластичный. Элемент состоит из 10 изотопов с ма ...
Абсорбционная установка непрерывного действия для поглощения аммиака
Попытки
синтеза аммиака из азота и водорода предпринимались многими учеными, начиная с
конца XVI вв., после того, как в 1784 г. крупнейший французский ученый
К. Бертолле уста ...
