Строение метанаСтатьи / Типы химических связей / Строение метана
Электронная конфигурация основного состояния изолированного атома углерода:
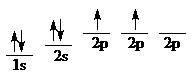
Рассмотрение электронного строения метана дает основание утверждать, что углерод 2-х валентен и должен образовывать соединения строения СН2, однако в метане углерод соединение 4 атомами углерода. Чтобы получить 4-х валентный углерод, необходимо иметь следующую схему распределения электронов:
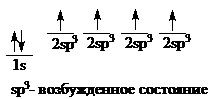
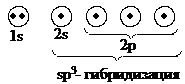
Возбужденное состояние атома включает образование четырех новых внешних орбиталей путем «гибридизации» 2s-орбитали и всех трех 2р-орбиталей. Четыре гибридные орбитали обладают одинаковой энергией, и каждая из них обозначается 2sp3. Гибридные орбитали обладают наибольшей степенью направленности, они точно эквивалентны друг другу. Главные оси четырех гибридных орбиталей направлены к углам правильного тетраэдра - расположение, при котором орбитали максимально удалены друг от друга.
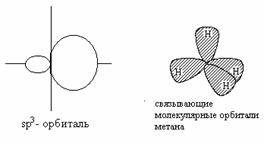
Угол связи (109,50) определяется условием максимального перекрывания гибридных орбиталей с орбиталями водорода.
Длина связи в метане 1,09 A.
Энергия связи 102 ккал/моль (417,05•103Дж/моль)
В отличии от ионной связи, прочность которой одинакова по всем направлениям, ковалентная связь является направленной.
Для углерода возможны три типа гибридизации:

Смотрите также
Ванадий (Vanadium), V
Этот элемент образует соединения с красивой окраской, отсюда и название элемента, связанное с именем скандинавской богини красоты Ванадис.
В промышленности при получении ванадия из железных руд с его ...
Америций (Americium), Am
Америций - искусственно полученный радиоактивный химический элемент, относится к актиноидам, атомный номер 95. Стабильных изотопов не имеет. Синтезирован в конце 1944 - начале 1945 американскими учёны ...
Лантаноиды
...
