СелективностьСтатьи / Степень превращения / СелективностьСтраница 2
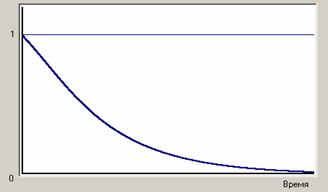
Рис.4
Для параллельной реакции 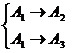 рассуждение о том, чему равна селективность в нулевой момент будут такими же, как для последовательной реакции, но только до того момента, когда мы захотим пренебречь концентрацией побочного продукта (
рассуждение о том, чему равна селективность в нулевой момент будут такими же, как для последовательной реакции, но только до того момента, когда мы захотим пренебречь концентрацией побочного продукта (![]() ). Для параллельной реакции этого сделать нельзя, так как побочный продукт образуется непосредственно из реагента и его количество будет соизмеримо с количеством целевого продукта. Так что, количество реагента, перешедшее в целевой продукт, будет всегда меньше, чем общее количество прореагировавшего реагента, так что селективность в нулевой момент времени будет меньше единицы. Реальное значение начальной селективности зависит от соотношения констант скоростей основной и побочной реакции.
). Для параллельной реакции этого сделать нельзя, так как побочный продукт образуется непосредственно из реагента и его количество будет соизмеримо с количеством целевого продукта. Так что, количество реагента, перешедшее в целевой продукт, будет всегда меньше, чем общее количество прореагировавшего реагента, так что селективность в нулевой момент времени будет меньше единицы. Реальное значение начальной селективности зависит от соотношения констант скоростей основной и побочной реакции.
Анализ зависимости селективности от времени также отличается от аналогичного анализа для последовательной реакции. Здесь также образуется побочный продукт, но целевой не расходуется, скорости образования целевого и побочного продуктов меняются во времени одинаково (в случае равенства порядков основной и побочной реакции) и селективность остается постоянной во времени.
Можно заметить, что три рассматриваемые характеристики взаимосвязаны, например, для последовательной реакции ![]() , анализируя расчетные формулы для степени превращения, выхода и селективности
, анализируя расчетные формулы для степени превращения, выхода и селективности ![]() ,
,![]() ,
,![]() , легко увидеть, что селективность и степень превращения всегда больше выхода, можно вывести простое соотношение между этими величинами. С учетом этого зависимость от времени этих трех характеристик для рассматриваемой реакции будет выглядеть как на рис.5.
, легко увидеть, что селективность и степень превращения всегда больше выхода, можно вывести простое соотношение между этими величинами. С учетом этого зависимость от времени этих трех характеристик для рассматриваемой реакции будет выглядеть как на рис.5.
Рис.5
В ходе теоретического анализа надо на время забыть все практические аспекты проведения работы, такие как тип и конструкцию реактора, характер теплообмена и т.д., и рассматривать только химическую реакцию. Тогда задача теоретического анализа данной работы может быть поставлена следующим образом:
Дана обратимая экзотермическая реакция:
к1
![]() А1 А2 + Q
А1 А2 + Q
к2
В каком температурном режиме лучше всего проводить эту реакцию? Под температурным режимом будем понимать зависимость наилучшей для реакции температуры (оптимальной) от времени протекания реакции.
Ответ на этот вопрос будет состоять из двух частей: сначала надо решить, при какой температуре нужно начать проведение этой реакции (чему равна наилучшая температура в начальный момент времени), затем подумать, как нужно будет менять эту температуру, чтобы обеспечить наилучшее протекание реакции. Но прежде всего, надо решить, по какому признаку мы будем судить о том, что реакция протекает наилучшим образом. По условию лабораторной работы такой характеристикой является степень превращения реакции (или выход целевого продукта). Но эта характеристика – практическая, привязанная к конкретной длине реактора (ко времени пребывания). Для теоретического рассмотрения для оценки качества протекания реакции будем использовать скорость реакции, и конкретно – скорость образования целевого продукта. Очевидно, что, чем больше продукта образуется в единицу времени, тем лучше протекает реакция. Теперь теоретический вопрос формулируется совершенно конкретно: как нужно менять температуру по ходу реакции, чтобы скорость образования продукта была бы наибольшей? Итак, при какой начальной температуре реакция начнется лучше всего? При какой температуре начальная скорость образования продукта будет максимальной? Запишем выражение для скорости образования продукта:
![]()
В момент начала реакции концентрация продукта равна нулю, следовательно в нулевой момент начальная скорость образования продукта запишется как:
![]()
В этом уравнении от температуры зависит константа скорости, чем выше температура, тем больше константа. Так что, чем выше температура, тем больше начальная скорость реакции, и начинать реакцию надо с максимально возможной температуры. Но как только реакция началась, появляется продукт реакции, и анализировать нужно уравнение скорости целиком. Теперь температура влияет на константу скорости прямой реакции, тем самым увеличивая скорость образования продукта, но одновременно увеличение температуры увеличивает константу скорости обратной реакции, что уменьшает скорость образования продукта. В этой ситуации надо понять, на какую из этих констант температура влияет сильнее. К примеру, если мы найдем, что температура влияет сильнее на константу скорости прямой реакции, то понижение температуры сильнее уменьшит константу скорости прямой реакции, и скорость образования продукта уменьшится. И наоборот. Константа скорости увеличивается с ростом температуры по уравнению Аррениуса, запишем это уравнение для обеих рассматриваемых констант.
Смотрите также
Кюрий (Curium), Cm
Назван в честь Пьера и Марии Кюри.
Кюрий-242 в виде окиси (плотность около 11,75 и период полураспада 162 дня) применяется для производства компактных и чрезвычайно мощных радиоизотопных источников эн ...
Синтез химико-технологической схемы
Задание
Требуется
синтезировать ХТС, работающую по следующей технологии:
Смесь,
состоящую из компонентов А и B и инертного компонента нагревается в системе
теплообмена до t1, пост ...
Моделирование стационарного и нестационарного истечения адиабатно-вскипающей жидкости из коротких
...
